La neumonía adquirida en la comunidad, en particular en sus formas graves (sCAP), sigue siendo un importante problema de salud pública debido a su frecuencia, sus complicaciones inmediatas y tardías, y el coste del tratamiento. Aunque poco frecuentes, los patógenos resistentes podrían dificultar cada vez más la elección de un tratamiento antibiótico empírico. Las técnicas rápidas de diagnóstico microbiológico molecular podrían ayudar a orientar esta elección, pero su papel debe evaluarse mejor y su coste podría obstaculizar su uso generalizado. La duración del tratamiento tiende a disminuir, pero podría orientarse por la progresión clínica y posiblemente por biomarcadores. Como trastorno de inflamación sistémica desregulada, la sCAP podría ser elegible para tratamiento inmunomodulador. Tres ensayos aleatorizados recientes de alta potencia sobre corticosteroides han arrojado resultados contradictorios. Es necesario definir mejor qué pacientes probablemente se beneficiarán, quizás aquellos con un síndrome inflamatorio marcado y, en cualquier caso, no aquellos con gripe. Algunos macrólidos también tienen un posible efecto inmunomodulador. Actualmente se están investigando otros tratamientos. Los cuidados de soporte, en particular el soporte respiratorio, siguen siendo esenciales. No es específico de sCAP y debe adaptarse a la gravedad de la condición del paciente.
Introducción
La neumonía adquirida en la comunidad (NAC) es una enfermedad infecciosa respiratoria muy frecuente con una incidencia general de entre 1 y 25 casos por 1000 habitantes por año. Esta incidencia aumenta con la edad, las comorbilidades (especialmente la EPOC) y cualquier tipo de inmunosupresión. Según estudios poblacionales, el 40% de los pacientes con NAC requieren hospitalización y el 5% de ellos ingresan en una Unidad de Cuidados Intensivos (UCI). La mortalidad de los pacientes con NAC sigue siendo inaceptablemente alta, alcanzando más del 30% cuando los pacientes requieren ventilación mecánica invasiva más shock. Pragmáticamente y como se define en las guías europeas y sudamericanas de 2023 (en adelante, guías ERS/ESICM/ESCMID/ALAT), el término NAC grave (sCAP) se refiere a los pacientes con NAC ingresados en la UCI. Obviamente, esta definición no puede extrapolarse totalmente a países con bajos recursos. Otra definición ampliamente utilizada es la de la American Thoracic Society y la Infectious Disease Society of America (ATS/IDSA) (Tabla 1a). Nuevamente, esta definición presenta problemas de viabilidad en países de bajos recursos, ya que una proporción considerable de pacientes con criterios menores son atendidos en salas convencionales. A pesar de que las guías recientes han revisado muchos aspectos de la sCAP, algunas cuestiones requieren actualización o revisión.

Epidemiología, puntuaciones de gravedad, pronóstico
Carga del sCAP
La incidencia anual de hospitalización por NAC en Estados Unidos (EE. UU.) es de aproximadamente 650 adultos por cada 100 000 habitantes, lo que corresponde a 1,5 millones de pacientes hospitalizados con NAC cada año. Entre los pacientes hospitalizados con NAC, la progresión a sCAP y la necesidad de ingreso en la UCI generalmente se debe a insuficiencia respiratoria, choque séptico o disfunción multiorgánica. La incidencia de sCAP en EE. UU. es de aproximadamente 145 casos por cada 100 000 habitantes de adultos, lo que corresponde a 350 000 pacientes con sCAP cada año. A nivel mundial, la incidencia de sCAP está aumentando, impulsada por el envejecimiento de la población, el mayor número de pacientes con multimorbilidad y el mayor número de individuos inmunocomprometidos. Las personas de menor nivel socioeconómico tienen casi el doble de riesgo de desarrollar sCAP.
Puntuaciones de gravedad
El diagnóstico clínico temprano de la sCAP es importante, ya que estos pacientes requerirán ingreso en la UCI para recibir apoyo fisiológico inmediato e intensivo. El diagnóstico de sCAP en un paciente continúa basándose principalmente en el criterio clínico del médico, ya que no existen pruebas clínicas o de laboratorio específicas para el diagnóstico. Se han desarrollado varios sistemas de puntuación para respaldar el criterio clínico al definir la gravedad de la enfermedad en un paciente con NAC. Puntuaciones como el Índice de Gravedad de la Neumonía (PSI) y la puntuación CURB-65 de la British Thoracic Society son eficaces para identificar a los pacientes con bajo riesgo de complicaciones, pero no predicen la necesidad de ingreso en la UCI. Los criterios de sCAP de la ATS/IDSA (Tabla 1a) y la puntuación SMART-COP (Tabla 1b) son más apropiados para la identificación temprana de los pacientes que requerirán ingreso en la UCI. También se han utilizado modelos de aprendizaje automático para desarrollar puntuaciones predictivas para el pronóstico o la necesidad de tratamientos de apoyo. Estos se discuten en el material complementario.
Pronóstico
Los pacientes con NAC y sCAP pueden experimentar secuelas agudas, que ocurren dentro de los 30 días del ingreso, y secuelas a largo plazo. Las secuelas agudas frecuentes incluyen empiema y absceso pulmonar, disfunción pulmonar, cardiovascular, renal y neurológica, deterioro de comorbilidades preexistentes y muerte. La mortalidad a 30 días entre los pacientes con sCAP es de aproximadamente el 30%. Las secuelas a largo plazo incluyen la progresión de comorbilidades preexistentes, desarrollo de nuevas enfermedades no transmisibles (p. ej., demencia, diabetes, insuficiencia cardíaca) y mortalidad a largo plazo. Se ha informado que la mortalidad a un año entre los pacientes con sCAP es del 47%. Las principales causas de estas muertes tardías son eventos cardiovasculares, progresión de la EPOC subyacente, cáncer e infecciones, incluido un nuevo episodio de neumonía. Un estudio de cohorte sugirió que el tratamiento con macrólidos dentro de las 48 h posteriores al ingreso a la UCI se asoció con una reducción significativa de la mortalidad a los 6 y 12 meses. Hasta la fecha, ningún ECA ha demostrado ningún efecto sobre estos resultados a largo plazo.
Patógenos involucrados
Dependiendo del método diagnóstico utilizado, los patógenos responsables de la sCAP varían considerablemente de un estudio a otro. Estudios anteriores, que no incluían pruebas virales exhaustivas, mostraron un predominio de bacterias, en particular Streptococcus pneumoniae. Sin embargo, el estudio Etiology of Pneumonia in the Community (EPIC), que realizó pruebas sistemáticamente más exhaustivas, halló que la infección viral podría ser más frecuente que la bacteriana. En la población de la UCI, el 22 % presentó solo infección viral, el 19 % presentó infección bacteriana pura y el 4 % presentó infección mixta. Esto último es de particular importancia, ya que, en caso de una prueba viral positiva, es necesario considerar la posibilidad de infección mixta, ya que la coinfección bacteriana aumenta significativamente el riesgo de un pronóstico desfavorable.
Los patógenos bacterianos comunes incluyen S. pneumoniae, Staphylococcus aureus sensible a la meticilina y bacterias gramnegativas entéricas. Cepas raras de S. aureus pueden secretar leucocidina de Panton-Valentine, que causa neumonía necrosante particularmente grave (véanse las notas a pie de página de la figura 3 para más detalles). Patógenos atípicos, como Legionella pneumophila y Mycoplasma pneumoniae, también pueden provocar neumonía adquirida en la comunidad (NAC), y su frecuencia puede variar según la zona geográfica y la época del año. La legionelosis no supera el 5 % de los casos de NAC, pero está sobrerrepresentada en la UCI debido a su gravedad. Con la presencia de factores de riesgo específicos del paciente, también se pueden observar S. aureus resistente a la meticilina (SARM) y bacterias gramnegativas más complejas, como Pseudomonas aeruginosa y Acinetobacter spp.
No existen estudios epidemiológicos extensos que hayan evaluado la distribución de los patógenos específicamente responsables de las formas graves de NAC. En el estudio EPIC citado anteriormente, de 482 pacientes ingresados en la UCI, se aisló S. pneumoniae en el 8%, S. aureus en el 5% y Enterobacterales spp. en el 3%. Un estudio de cohorte unicéntrico halló que, entre 664 casos de NAC esporádica, incluidos 336 con uno o más patógenos aislados, S. pneumoniae representó el 55% de los casos, virus respiratorios el 16%, L. pneumophila el 9%, P. aeruginosa el 7% y S. aureus el 6%, sin detalles sobre su sensibilidad a la meticilina. Se aislaron múltiples patógenos en el 17% de los casos. La Iniciativa Global Contra la Neumonía por Staphylococcus aureus Resistente a la Meticilina (GLIMP) fue un estudio multicéntrico internacional que incluyó datos de prevalencia puntual en adultos hospitalizados por NAC durante 4 días en 2015. Se incluyó un total de 3702 pacientes de 54 países y 222 hospitales, de los cuales 1173 (37%) tenían al menos un patógeno identificado. Streptococcus pneumoniae fue el patógeno identificado con mayor frecuencia (8,2% de todos los pacientes), con resistencia a la penicilina en el 0,5% de las cepas. Pseudomonas aeruginosa representó el 4,1% de los patógenos aislados. La prevalencia general de NAC por SARM fue del 3,0%, con disparidades significativas entre países y una prevalencia significativamente mayor en Estados Unidos que en Europa Occidental. Se aislaron Enterobacterales spp. en el 6% de las NAC, principalmente Klebsiella pneumoniae y Escherichia coli, con una prevalencia mayor en África (18%). Entre estas cepas, se encontró resistencia a al menos un antibiótico en el 3,1 % de las NAC, y resistencia a múltiples fármacos (MDR), es decir, a al menos tres antibióticos, en el 1,2 %. Otros estudios han encontrado proporciones similares en poblaciones más específicas. A diferencia de otros estudios, como EPIC, el estudio GLIMP no contó con un enfoque sistemático para las pruebas etiológicas, y solo se detectó un patógeno en el 36,5 % de los casos, y solo en el 61,8 % se obtuvo un cultivo de esputo. Además, no se trató de un estudio exclusivamente en UCI, lo que limita la generalización de los datos a pacientes con NAC esporádica.
En la mayoría de los pacientes con NAC grave y factores de riesgo documentados de neumonía por aspiración o antecedentes de aspiración presenciada, los patógenos son los mismos que en quienes no la presentan. Las bacterias anaerobias rara vez se aíslan y no justifican el uso rutinario de agentes antianaerobios.
Patógenos bacterianos poco comunes pueden causar NAC en huéspedes y exposiciones específicos, como Mycobacterium tuberculosis, Francisella tularensis y Acinetobacter spp. Los hongos pueden causar NAC en pacientes con deterioro inmunitario grave, incluyendo el uso de corticosteroides a dosis altas, que pueden predisponer a la infección por Aspergillus spp., Cryptococcus spp. y Pneumocystis jiroveci. Algunos hongos pueden causar NAC en zonas geográficas endémicas y causar infecciones como coccidiomicosis, blastomicosis e histoplasmosis.
Al definir los factores de riesgo para patógenos inusuales, es fundamental revisar las comorbilidades del paciente, su historial de hospitalización en los últimos 90 días, los cultivos de las vías respiratorias, el uso reciente de antibióticos y el contacto con el entorno sanitario. Se han desarrollado sistemas de puntuación y modelos de aprendizaje automático para predecir la PAC por patógenos multirresistentes, pero su papel en la elección del tratamiento para la PAC es incierto. En muchos pacientes con enfermedad grave, se opta por el tratamiento empírico asumiendo que estos patógenos son una posibilidad probable, de acuerdo con la ecología bacteriana local, y evitando el uso excesivo de antibióticos de amplio espectro. A continuación, se analiza el posible papel de las técnicas de diagnóstico microbiológico rápido en el diagnóstico de estas infecciones.
Respuesta inmune e inflamatoria
En las últimas dos décadas, una extensa investigación clínica y translacional ha demostrado que los resultados de la NAC están determinados principalmente por la respuesta inmunitaria del huésped, más que por la carga microbiana únicamente. Una activación exagerada y prolongada del sistema inmunitario innato en la NAC espontánea impulsa la inflamación sistémica, la lesión endotelial y la disfunción multiorgánica. Los estudios de biomarcadores han demostrado que los niveles elevados de marcadores inflamatorios, como la interleucina-6 (IL-6), el factor de necrosis tumoral-α (TNF-α), el dímero D y la proteína C reactiva (PCR), se correlacionan con la gravedad de la enfermedad, el fracaso del tratamiento y los resultados adversos. Es importante destacar que la inflamación sistémica a menudo persiste durante semanas después de la resolución de los signos clínicos, lo que destaca que la recuperación biológica se retrasa con respecto a la mejoría de los síntomas. Al alta hospitalaria, los niveles de IL-6 y dímero D permanecen elevados en muchos pacientes clínicamente estables y predicen de forma independiente la mortalidad a 1 año y los eventos cardiovasculares tardíos, como el infarto de miocardio y el accidente cerebrovascular. Este conocimiento en evolución ha replanteado la sCAP como un trastorno de inflamación sistémica desregulada, en el que la magnitud, la duración y la resolución de la respuesta del huésped —que refleja la eficacia de las correcciones homeostáticas—, en lugar de la eliminación del patógeno por sí sola, determinan la progresión de la enfermedad, la recuperación y el riesgo de complicaciones a largo plazo.
Un cambio de paradigma significativo en la patobiología de las enfermedades críticas ha surgido del reconocimiento de que la supervivencia depende no solo de la eliminación del patógeno, sino también de la capacidad del sistema de señalización del receptor de glucocorticoides alfa (GRα) para restablecer la homeostasis mediante la regulación dinámica de la respuesta inmunitaria. Activado por la liberación de cortisol inducida por el estrés, el GRα funciona en tres fases distintas: preparación, modulación y restauración. En las enfermedades críticas, el sistema inmunitario innato proporciona una defensa rápida e inespecífica activando neutrófilos, monocitos y células asesinas naturales a través de receptores de reconocimiento de patrones, incluidos los receptores tipo Toll, que detectan patrones moleculares asociados a patógenos y daños. Es importante destacar que esta respuesta requiere una adaptación metabólica continua, respaldada por la bioenergética mitocondrial.
GRα es esencial para coordinar la respuesta inmunitaria innata al integrar señales de estrés y programas transcripcionales que amplifican los mecanismos de defensa tempranos, a la vez que previenen la lesión tisular inmunomediada. En la fase de preparación, GRα co-regula la expresión génica con factores de transcripción proinflamatorios, como el factor nuclear-κB (NF-κB), la proteína activadora-1 (AP-1) y el TNF-α, para potenciar la respuesta inflamatoria necesaria para la eliminación microbiana. Esta cooperación transcripcional aumenta la accesibilidad de la cromatina y potencia la expresión génica en la producción de citocinas y quimiocinas, la activación del complemento y la fagocitosis.
Al mismo tiempo, GRα ejerce un control regulador mediante la inducción de mediadores antiinflamatorios como la cremallera de leucina inducida por glucocorticoides (GILZ) y la anexina-1, lo que facilita la eliminación eficiente de patógenos y previene la sobreactivación inmunitaria y el daño tisular.
En la transición a la respuesta inmunitaria adaptativa, GRα modula la supervivencia, la proliferación y la producción de citocinas de los linfocitos, promoviendo así la resolución inmunitaria y la reparación tisular. Esta regulación específica de fase favorece la tolerancia a la microbiota comensal, a la vez que mantiene una defensa robusta contra los patógenos.
En conjunto, GRα orquesta una interacción estrechamente regulada entre la inmunidad innata y la adaptativa, garantizando una activación inmunitaria proporcional durante la fase de preparación y la restauración de la homeostasis inmunitaria durante la fase de recuperación de la enfermedad crítica.
Diagnóstico clínico y radiológico
El diagnóstico precoz de la neumonía adquirida en la comunidad (NAC) requiere un enfoque integral que integre el juicio clínico con estrategias avanzadas de imagen. Los pacientes suelen presentar fiebre, tos, disnea, dolor torácico pleurítico y signos sistémicos como hipotensión, confusión o insuficiencia respiratoria, lo que refleja una alta carga inflamatoria y una posible disfunción multiorgánica. La ausencia de fiebre puede ocurrir en ancianos y hasta en el 30% de los pacientes.
No todas las consolidaciones pulmonares son neumonía, y una revisión reciente ha enumerado otros diagnósticos a considerar. Los hallazgos radiográficos desempeñan un papel fundamental no solo en el diagnóstico, sino también en la evaluación de la gravedad. Se ha demostrado que la afectación multilobulada bilateral, pero no la unilateral, se asocia de forma independiente con un aumento de la mortalidad a los 30 días, lo que enfatiza la necesidad de considerar la distribución de los infiltrados en el pronóstico.
Una tomografía computarizada de tórax puede ser útil si existe una fuerte sospecha clínica de NAC sin infiltrados en la radiografía de tórax, en casos de inmunodeficiencia, fracaso del tratamiento o sospecha de complicaciones como la formación de abscesos.
La ecografía pulmonar (EUP) se está consolidando como una valiosa herramienta de cabecera. Permite la rápida identificación de derrames pleurales, consolidaciones subpleurales y patrones intersticiales, lo que resulta especialmente útil cuando los hallazgos de la radiografía de tórax no son concluyentes o cuando la TC no es factible, especialmente en países de bajos ingresos. Una revisión sistemática demostró una alta sensibilidad (≥ 0,91 en la mayoría de los estudios) y una especificidad aceptable de la EUP para el diagnóstico de la NAC, incluso cuando la realizan especialistas no especializados en imagenología, como médicos de urgencias o intensivistas, con una formación breve. Estos hallazgos respaldan la utilidad de la EUP para la evaluación inicial y el seguimiento de pacientes con NAC. El uso de inteligencia artificial para interpretar los datos de imagenología e integrarlos en la evaluación pronóstica se analiza en el material complementario.
Biomarcadores
Los biomarcadores pueden aportar información importante (probabilidad posprueba) a la sospecha clínica de sCAP (probabilidad preprueba), lo que podría mejorar la precisión de su diagnóstico y su tratamiento, siempre que se conozcan su biología y los posibles factores de confusión.
Entre los biomarcadores de respuesta del huésped, los más estudiados han sido la proteína C reactiva (PCR) y la procalcitonina (PCT).
Uso en diagnóstico
Una sola medición de PCR y PCT tiene un rendimiento diagnóstico modesto para la sCAP, siendo la primera más sensible y la segunda más específica. Además, ambas presentan un rendimiento modesto para distinguir entre NAC viral y bacteriana. El tiempo transcurrido desde el inicio de los síntomas hasta la sospecha de NAC debe considerarse al interpretar los niveles de biomarcadores: la PCR se encontró elevada independientemente de la duración de los síntomas, pero a mayor duración, mayores niveles; por otro lado, los niveles de PCT disminuyeron notablemente (>50%) cuando la duración de los síntomas fue ≥3 días. Utilizando la tomografía computarizada de tórax como estándar de oro, el nivel de PCR demostró ser un buen marcador de falsos negativos y falsos positivos en la radiografía de tórax, mientras que la PCT mostró un bajo nivel de discriminación.
Los biomarcadores de sepsis están altamente correlacionados y su combinación no suele mejorar la precisión diagnóstica, como lo demuestra un estudio que evaluó 53 biomarcadores, en el que ninguna combinación tuvo mejor desempeño que la PCR sola para distinguir entre pacientes infectados y no infectados entre aquellos que cumplían los criterios del síndrome de respuesta inflamatoria sistémica.
Uso para guiar la terapia con antibióticos
Tras la prescripción de antibióticos, la cinética de los biomarcadores podría ser útil para evaluar la respuesta a la NAC. Al tercer o cuarto día de tratamiento, la PCR disminuyó entre un 30 % y un 40 % con respecto a los niveles basales en los supervivientes, mientras que en los no supervivientes, los niveles se mantuvieron prácticamente sin cambios. Los cambios individuales en la PCR se correlacionan con el pronóstico, y las disminuciones rápidas o lentas se asocian a un mejor pronóstico que las respuestas bifásicas o ausentes. La presencia de neutropenia no influye en los niveles de PCR ni en la cinética. En ensayos aleatorizados, la PCR disminuye más rápidamente en pacientes que reciben corticosteroides que en aquellos que reciben placebo.
Un ECA evaluó la prescripción de antibióticos guiada por PCT en NAC no grave, mostrando que el grupo guiado por PCT resultó en una exposición a antibióticos y una duración del tratamiento significativamente menores. Este resultado se ve mitigado por la larga duración del tratamiento (12,9 días) en el grupo de atención estándar, lo cual no se ajusta a las recomendaciones actuales. En pacientes de UCI, un ensayo aleatorizado reciente combinó la mPCR respiratoria de amplio espectro y las mediciones secuenciales de PCT con el estándar de atención. Esta estrategia no redujo la exposición a antibióticos ni mejoró los resultados al día 28. Otros ECA que evaluaron algoritmos guiados por PCT en sepsis incluyeron proporciones variables de pacientes con NAC. Un metaanálisis sugirió que estos algoritmos pueden reducir la duración de la terapia con antibióticos, pero en la misma medida que una reducción sistemática preespecificada en la duración. Por lo tanto, las directrices ERS/ESICM/ESCMID/ALAT sugieren el uso de PCT para reducir la duración de la terapia con antibióticos, a menos que se logre la estabilidad clínica rápidamente y la terapia con antibióticos se limite a 5-7 días. Se pueden utilizar pruebas seriadas de PCT y PCR si la neumonía no responde al tratamiento dentro del plazo habitual, para evaluar la respuesta a los antibióticos. Sin embargo, en muchos casos de evolución simple, los biomarcadores no han demostrado ningún beneficio, y su costo debe tenerse en cuenta.
Diagnóstico microbiológico
Las pruebas diagnósticas habituales para sCAP son cultivo de secreciones del tracto respiratorio inferior, hemocultivos, antígenos urinarios de Legionella y neumococo, y pruebas virales. Existe variabilidad en el rendimiento del cultivo respiratorio basado en el tipo de muestra del tracto respiratorio, el microorganismo causal y el tratamiento previo con antibióticos. El esputo de alta calidad, definido como una muestra con menos de 10 células epiteliales escamosas y más de 25 leucocitos, es difícil de obtener y puede tener un rendimiento diagnóstico tan bajo como 14%. Los aspirados endotraqueales y el líquido de lavado broncoalveolar son métodos de muestreo alternativos en pacientes intubados. La calidad de estas muestras también debe evaluarse. Los estudios muestran tasas más altas de diagnóstico microbiológico utilizando métodos de muestreo invasivos en comparación con el esputo (56% vs. 39%, p = 0,018). Sin embargo, incluso cuando se combina con otras pruebas convencionales, no se identifica ningún patógeno hasta en el 49% de los pacientes con sCAP. Además del bajo rendimiento, otras limitaciones de los diagnósticos basados en cultivos son el tiempo de respuesta prolongado y los requisitos que requiere el laboratorio de microbiología para realizarlos (Fig. 1).
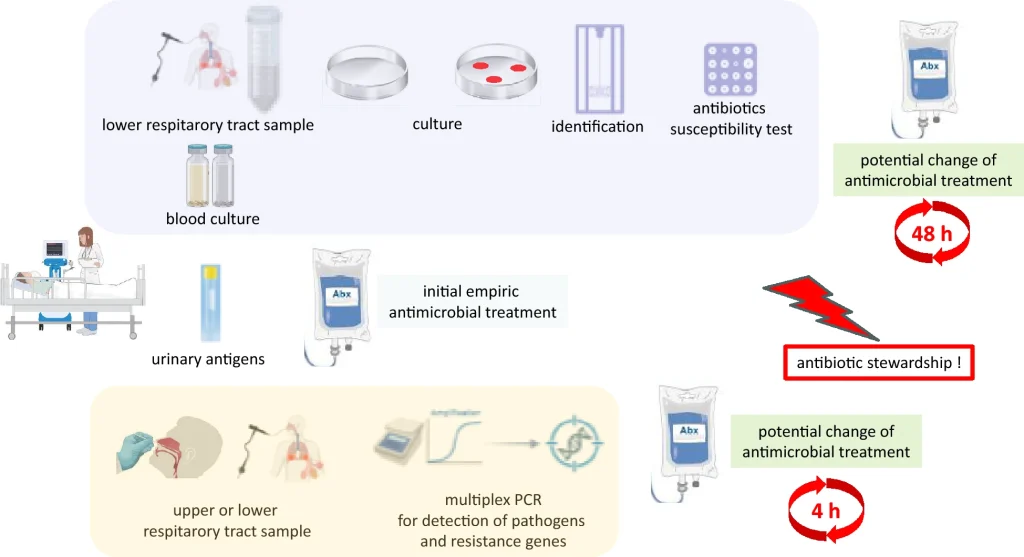
Se han desarrollado nuevos diagnósticos independientes del cultivo, como los paneles de reacción en cadena de la polimerasa (PCR) multiplex, para abordar algunas limitaciones de los diagnósticos convencionales. La PCR multiplex puede ser especialmente útil en pacientes con sCAP que presentan factores de riesgo de patógenos resistentes a los antibióticos estándar o en shock séptico, en quienes se prescriben empíricamente antibióticos de amplio espectro. En estos pacientes, el alto valor predictivo negativo de la PCR podría conducir a una desescalada segura de la dosis de antibióticos al descartar bacterias como P. aeruginosa y SARM. Además, la PCR puede proporcionar evidencia para la desescalada de antibióticos de amplio espectro mediante la detección de patógenos altamente sensibles a los antibióticos, como S. pneumoniae o S. pyogenes, o patógenos difíciles de cultivar, como Legionella spp. En consecuencia, las directrices ERS/ESICM/ESCMID/ALAT recomiendan, si la tecnología está disponible, enviar una muestra del tracto respiratorio inferior para la prueba de PCR multiplex siempre que se prescriban o consideren antibióticos no estándar para sCAP. Los estudios que han demostrado el beneficio de las pruebas de PCR multiplex han combinado su uso con recomendaciones para el uso responsable de antibióticos para los médicos. En ausencia de estas recomendaciones, ningún estudio hasta la fecha ha demostrado un beneficio de la PCR multiplex para reducir la duración del tratamiento antibiótico.
Las futuras directrices para el diagnóstico microbiológico en la sCAP incluyen la optimización de las estrategias de implementación de las pruebas de amplificación de ácidos nucleicos, incluyendo la secuenciación metagenómica, y los análisis de coste-efectividad. También debe investigarse la influencia de la administración previa de antibióticos.
Tratamiento de apoyo
La insuficiencia respiratoria aguda (IRA) es un problema importante en pacientes con neumonía adquirida en la comunidad (NAC). La oxigenoterapia convencional (OCC) es el tratamiento de primera línea para la IRA en los casos menos graves. Sin embargo, se puede administrar soporte respiratorio en condiciones clínicas más graves. En casos de IRA potencialmente mortal, se requerirá ventilación mecánica invasiva (VMI) o incluso oxigenación por membrana extracorpórea (ECMO). Estrategias no invasivas, como la terapia nasal de alto flujo (TNAF) o la ventilación no invasiva (VNI) mediante mascarilla o casco, podrían cubrir la brecha entre la OCC y la VMI. El objetivo de todas las medidas de soporte para la IRA es ganar tiempo para que el tratamiento antimicrobiano cure la neumonía.
Debido a la escasez de estudios que aborden el soporte respiratorio en esta población y al hecho de que la mayoría de los casos de IRA hipoxémica o síndrome de dificultad respiratoria aguda (SDRA) se deben a neumonía, las recomendaciones de las guías para el SDRA pueden aplicarse razonablemente en pacientes con NAC grave.
Existe incertidumbre sobre qué pacientes con neumonía adquirida en la comunidad tienen más probabilidades de beneficiarse de cada estrategia de soporte no invasivo. La HFNT puede ser el enfoque de primera línea en la mayoría de los pacientes, y se recomienda encarecidamente sobre la COT para reducir el riesgo de intubación, pero no la mortalidad. Si bien la VNI puede estar relativamente contraindicada en pacientes con secreciones excesivas, vello/estructura facial que resulte en fugas de aire o mala adherencia, la VNI puede ser preferible en aquellos con mayor trabajo respiratorio, disnea más severa, fatiga de los músculos respiratorios e insuficiencia cardíaca congestiva, en quienes la presión positiva de la VNI puede impactar positivamente la hemodinámica. Se puede utilizar la VNI mediante mascarilla facial o casco, dependiendo de la experiencia del equipo, ya que la superioridad de uno sobre el otro no se ha demostrado formalmente. Se podría considerar una prueba de VNI para pacientes seleccionados con IRA hipoxémica si no hay contraindicaciones (estado neurológico notablemente deteriorado), con una estrecha monitorización por parte de un equipo clínico experimentado que pueda intubar a los pacientes rápidamente si se deterioran.
En pacientes intubados que reciben VMI, se deben aplicar estrategias de ventilación mecánica protectora para reducir la mortalidad, basadas en: (1) el uso de ventilación con bajo volumen corriente (4-8 ml/kg de peso corporal previsto) y presiones inspiratorias más bajas (presión meseta ≤ 30 cmH₂O); (2) posición prona inmediatamente después de la intubación si, tras un período de estabilización durante el cual se ajusta la PEEP, la PaO₂/FiO₂ permanece < 150 mmHg, aplicada durante sesiones prolongadas (≥ 16 horas consecutivas). No se recomiendan las maniobras de reclutamiento ni el uso rutinario de infusiones continuas de bloqueantes neuromusculares.
Finalmente, pacientes con criterios de SDRA muy graves, indicados por: (1) PaO₂/FiO₂ < 50 mmHg durante > 3 h; (2) PaO2/FiO2 < 80 mmHg durante > 6 h; o (3) pH arterial < 7,25 con PaCO2 ≥ 60 mmHg durante > 6 h, debe tratarse con ECMO venovenoso en un centro de ECMO que cumpla con los estándares organizacionales definidos.
La Figura 2 resume los elementos esenciales del tratamiento de la sCAP.
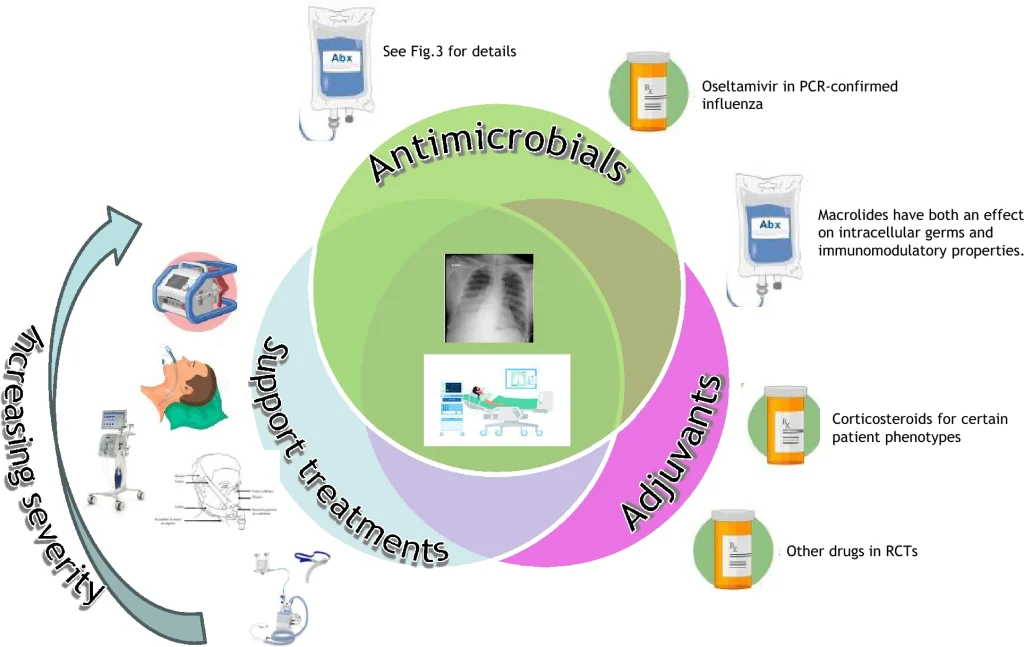
Estrategias de tratamiento antiinfeccioso
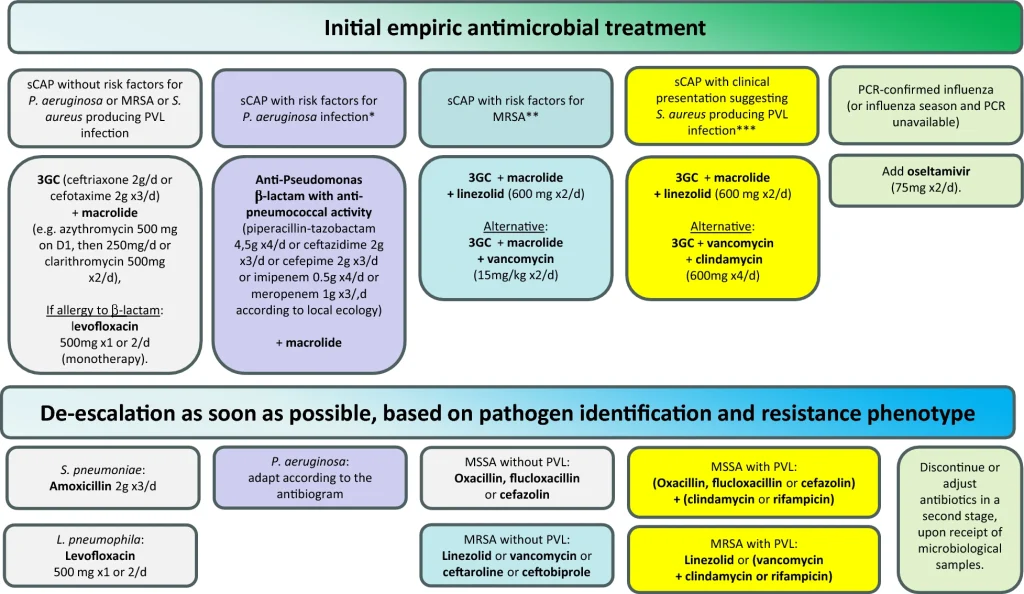
El inicio oportuno de la terapia antibiótica apropiada impacta significativamente el pronóstico de la sCAP. Las estrategias de tratamiento actuales en pacientes sin riesgo de patógenos resistentes a los fármacos implican una combinación de β-lactáminas con un macrólido o una fluoroquinolona, siendo esta última la preferida para la sCAP causada por Legionella. Sin embargo, la creciente prevalencia de SARM y bacterias gramnegativas resistentes complica el manejo, requiriendo una evaluación de riesgos basada en hospitalizaciones recientes, comorbilidades y exposición previa a antibióticos. En este contexto, los antibióticos más nuevos, como la ceftarolina y el ceftobiprol, han demostrado eficacia tanto en RCTs como en estudios observacionales, y podrían ser la opción preferida cuando la cobertura empírica contra SARM esté razonablemente justificada. La delafloxacina, la lefamulina y la omadaciclina han sido aprobadas por la FDA con base en ensayos de no inferioridad. Pueden ser alternativas a moléculas más antiguas en algunos casos, pero su lugar aún está por determinar, especialmente en la sCAP donde no se han evaluado. Además, se debe considerar el uso empírico de oseltamivir durante la temporada de gripe cuando no se dispone de PCR para el diagnóstico de la gripe. La duración recomendada del tratamiento antibiótico para la sCAP es de al menos 5 días si se logra estabilidad clínica, asumiendo que la estabilidad clínica no está bien definida en pacientes con ventilación mecánica. Puede ser mayor, dependiendo del estado clínico e inmunitario del paciente.
Los patógenos intracelulares son naturalmente resistentes a los betalactámicos, por lo que se recomienda combinarlos con un antibiótico activo contra estos organismos. Las directrices ERS/ESICM/ESCMID/ALAT favorecen un macrólido, en parte debido al mayor riesgo de eventos cardiovasculares graves con las fluoroquinolonas y en parte debido al efecto inmunomodulador de ciertos macrólidos. Esto se basa en metaanálisis de estudios observacionales y dos ECA doble ciego que respaldan la adición de claritromicina a los betalactámicos. En el primer ECA, la incidencia de inestabilidad hemodinámica y reingreso hospitalario fue menor con la combinación de claritromicina y β-lactámicos en comparación con la monoterapia con β-lactámicos. En el ECA ACCESS, los pacientes fueron aleatorizados para recibir placebo oral o claritromicina durante 7 días, en combinación con un β-lactámico (o moxifloxacino en caso de infección por L. pneumophila). El criterio de valoración principal fue una reducción en la intensidad de los síntomas respiratorios y una reducción en la puntuación SOFA o PCT durante las primeras 72 h de tratamiento. Este criterio de valoración se alcanzó en el 67,9% de los pacientes que recibieron claritromicina en comparación con el 38,3% de los pacientes que recibieron placebo (p < 0,0001). Se observó una menor progresión a insuficiencia respiratoria (6,0 % frente a 17,3 %) y sepsis secundaria (13,4 % frente a 24,1 %), así como un mayor número de altas hospitalarias (79,1 % frente a 62,4 %) con claritromicina. Este beneficio también se observó en pacientes tratados con corticosteroides. El estudio de inmunidad confirmó la corrección de la parálisis inmunitaria en pacientes que recibieron claritromicina. No existen ensayos que comparen un macrólido con otro. Al elegir un macrólido, se deben tener en cuenta las interacciones farmacológicas y los efectos secundarios cardiovasculares.
La Figura 3 resume las recomendaciones recientes para el tratamiento antiinfeccioso de la sCAP. Nos remitimos a una revisión reciente sobre la terapia antibiótica para infecciones graves, ya que el formato de este artículo no permite mayor detalle sobre las ventajas y desventajas de los antibióticos o las combinaciones propuestas en estas recomendaciones.
Terapia adyuvante
Los corticosteroides, que supuestamente controlan la inflamación desregulada, han sido los tratamientos adyuvantes más estudiados. Tres grandes ensayos multicéntricos recientes se realizaron en pacientes de la UCI, con resultados opuestos. El ensayo ESCAPE no encontró un beneficio de supervivencia al día 60 en 297 pacientes que recibieron metilprednisolona, en comparación con 285 pacientes que recibieron placebo, ni mostró una diferencia en ninguno de los resultados secundarios. Por el contrario, el ensayo CAPE COD mostró una disminución significativa de la mortalidad al día 28 (6,2% frente a 11,9%) en 400 pacientes que recibieron hidrocortisona, en comparación con 395 pacientes que recibieron placebo. Los pacientes que recibieron hidrocortisona requirieron un uso significativamente menos frecuente de intubación traqueal y vasoconstrictor después de la aleatorización. El ensayo de plataforma adaptativa REMAP-CAP publicó recientemente su dominio de corticosteroides de duración fija, que comparó 7 días de hidrocortisona con el tratamiento estándar en un entorno abierto, y concluyó que era improbable que la hidrocortisona resultara en una reducción significativa de la mortalidad a los 90 días. Además, se observó un riesgo relativo de muerte asociado con la hidrocortisona (RR: 1,52; IC del 95 %: 0,81-2,80). En un análisis bayesiano, la probabilidad de daño por hidrocortisona osciló entre el 84,3 % y el 90,8 %.
La explicación de estos resultados contradictorios sigue siendo hipotética hasta la fecha. Más allá de las diferencias en los métodos y la casuística entre estos ensayos, sus resultados sugieren que se debería definir mejor el fenotipo de los pacientes para identificar a aquellos que podrían beneficiarse de los corticosteroides. De esta manera, un metaanálisis reciente de datos de pacientes individuales de ocho ensayos (excluyendo REMAP-CAP, que aún no estaba disponible) sugiere que la reducción de la mortalidad lograda con corticosteroides se limitó a pacientes con niveles iniciales de PCR altos por encima de 204 mg/L.
Hasta la fecha, solo un metanálisis ha integrado los resultados de los tres ensayos citados anteriormente, así como otros ensayos en NAC y ensayos en sepsis y shock séptico o síndrome de dificultad respiratoria aguda, siempre que se conociera la tasa de mortalidad en el subgrupo de NAC. Este metanálisis concluyó con moderada certeza que los corticosteroides probablemente reducen la mortalidad al mes en la NAC (RR 0,82 [IC del 95 %: 0,74-0,91]) y con alta certeza que reducen la necesidad de ventilación mecánica invasiva (RR 0,63 [IC del 95 %: 0,48-0,82]). En pacientes con neumonía complicada con shock séptico, un análisis post hoc del ensayo APROCCHSS sugirió que el beneficio de la combinación de hidrocortisona y 9-alfa fludrocortisona se limitó al shock séptico de origen pulmonar.
La tolerancia a los corticosteroides parece buena en la NAC, salvo por una hiperglucemia más frecuente. En particular, el riesgo, a menudo temido, de infección secundaria no parece aumentar.
Se carece de datos sobre la eficacia o la tolerancia por patógeno. En la NAC relacionada con SARS-CoV-2, los corticosteroides mejoraron la supervivencia en pacientes tratados con oxígeno o ventilación mecánica, a pesar de no disponerse de medicación antiviral activa. Sin embargo, en la neumonía gripal, los datos disponibles, procedentes casi exclusivamente de estudios de cohortes, sugieren un aumento de la mortalidad en pacientes que reciben corticosteroides, por lo que no deberían prescribirse en estas circunstancias. No existen datos sobre pacientes inmunodeprimidos, excepto en el caso de la neumocistosis, en la que los corticosteroides mejoraron la supervivencia en pacientes con infección por VIH. En pacientes sin infección por VIH, un ensayo reciente observó una disminución no significativa de la mortalidad a los 28 días en pacientes tratados con metilprednisolona (21,5 % frente a 32,4 %, p = 0,07), con una mortalidad hospitalaria y a los 90 días significativamente menor con corticosteroides, así como una menor proporción de intubación secundaria.
El efecto antiinflamatorio de los macrólidos se ha comentado anteriormente. Otros fármacos han mostrado resultados prometedores en ensayos de fase 1 o 2, pero estos resultados aún no se han confirmado. Se analizan en el material complementario.
Cuestiones pendientes
Es necesario explorar áreas de investigación de gran relevancia, en particular en lo que respecta a la rentabilidad de las técnicas de diagnóstico rápido, el papel de los biomarcadores, el papel de la inteligencia artificial, las indicaciones de los corticosteroides y macrólidos, y el desarrollo de nuevos tratamientos dirigidos a la respuesta huésped-patógeno. En ciertas zonas geográficas, la alta incidencia de patógenos resistentes a los antibióticos plantea enormes desafíos, y el uso irracional de antibióticos de amplio espectro probablemente agrave la situación. La aplicabilidad de las directrices en países de bajos ingresos también es crucial. Optimizar la organización de la atención (evaluar correctamente a los pacientes, tratarlos con rapidez y derivarlos a la unidad más adecuada) probablemente desempeñe un papel fundamental en la mejora del pronóstico de los pacientes más vulnerables.


