Introducción
La candidiasis invasiva (CI) es una infección fúngica potencialmente mortal que afecta desproporcionadamente a pacientes críticos. Aproximadamente un tercio de las infecciones por Candida spp. transmitidas por la sangre ocurren en pacientes ingresados en unidades de cuidados intensivos (UCI). Estos individuos son particularmente vulnerables debido a una combinación de factores, que incluyen la exposición a antibióticos de amplio espectro, procedimientos invasivos y dispositivos endovasculares, inmunoparálisis, terapias de soporte orgánico y nutrición parenteral total. En la UCI, la CI es una complicación importante asociada con la hospitalización prolongada y el aumento de la utilización de recursos a pesar de la terapia antifúngica. La mortalidad por infecciones del torrente sanguíneo por Candida spp. (candidemia) en adultos generalmente varía del 30 al 60%, y puede superar el 70% entre los pacientes críticos de la UCI. Candida albicans sigue siendo la especie más comúnmente aislada en todo el mundo; sin embargo, la proporción de Candida no albicans spp. (en particular, C. glabrata, C. parapsilosis y C. auris, resistente a múltiples fármacos) ha aumentado en las últimas dos décadas, con variaciones geográficas e importantes implicaciones terapéuticas. La tasa de mortalidad se ha mantenido sin cambios en las últimas dos décadas, aunque varía según la ubicación y la casuística.
Esta revisión narrativa multidisciplinaria, desarrollada con la colaboración de expertos en cuidados intensivos, enfermedades infecciosas, microbiología y farmacología, ofrece orientación práctica para el manejo de las infecciones por Candida spp. en pacientes críticos. Con énfasis en la toma de decisiones a pie de cama, integra los avances recientes con las perspectivas de expertos para respaldar la práctica clínica diaria, fomentar la colaboración entre especialidades y promover la atención individualizada y basada en la evidencia en la UCI.
Estrategia de búsqueda y criterios de selección
Esta revisión narrativa se realizó para consolidar el conocimiento actual sobre la CI y la candidemia en pacientes críticos, con especial atención a las infecciones por Candida spp. que ocurren en la UCI. Se realizó una búsqueda bibliográfica exhaustiva en las bases de datos PubMed, Embase y Web of Science. La búsqueda empleó una combinación de Encabezados de Tema Médico (MeSH) y términos de texto libre, como «candidiasis invasiva», «candidemia», «Candida», «infecciones por levaduras», «pacientes críticos», «unidad de cuidados intensivos», «terapia antifúngica», «biomarcadores de diagnóstico» y «resistencia a los antifúngicos».
Se aplicaron filtros para restringir los resultados a estudios con poblaciones adultas en la UCI, con la limitación de idioma al inglés. El rango de fechas abarcó desde 2000 hasta 2025 para reflejar los avances fundamentales y recientes en epidemiología, diagnóstico, estrategias de tratamiento y optimización del uso de antifúngicos relevantes para la atención en la UCI.
También se revisaron las listas de referencias de artículos clave y guías clínicas relevantes para garantizar la inclusión de estudios importantes no incluidos en la búsqueda inicial en la base de datos. Las publicaciones elegibles incluyeron ensayos controlados aleatorizados, estudios de cohorte observacionales, revisiones sistemáticas, guías clínicas relevantes y comentarios de expertos que aportaron datos o perspectivas de expertos sobre el diagnóstico, el tratamiento o los resultados de las infecciones por Candida spp. en la UCI. Se excluyeron los estudios centrados exclusivamente en infecciones por moho o en poblaciones no hospitalizadas en la UCI.
Esta revisión no representa una revisión sistemática, un proceso Delphi ni una declaración formal de consenso. Más bien, refleja una síntesis multidisciplinaria del conocimiento actual realizado por expertos en cuidados intensivos, enfermedades infecciosas, microbiología y farmacología, para orientar la práctica y la investigación futuras en el manejo de la CI en pacientes críticos.
Cambios en la epidemiología y los factores de riesgo
La epidemiología de la CI en pacientes críticos continúa evolucionando con la cambiante combinación de casos, la exposición al dispositivo y la presión de selección de antifúngicos. Los estudios multicéntricos estiman la CI adquirida en la UCI en aproximadamente 7 por 1000 admisiones con aproximadamente el 42% de mortalidad a 30 días (EUCANDICU), mientras que otras cohortes informan de candidemia en la UCI en aproximadamente 4,8 por 1000 admisiones con un 47% de mortalidad a 28 días y un 60% a 180 días. La distribución de especies ha cambiado hacia Candida non-albicans spp. con una creciente resistencia a los azoles. El estudio ECMM Candida III (2018-2022) informó de una resistencia al fluconazol de aproximadamente el 12% en C. glabrata (e incluso C. glabrata resistente a las equinocandinas) y de aproximadamente el 17% en C. parapsilosis en partes del sur de Europa, con una resistencia a las equinocandinas poco común pero presente, incluidas las mutaciones FKS. Entre las amenazas nosocomiales importantes se encuentran C. auris y C. parapsilosis resistente al fluconazol, que persisten en entornos sanitarios, causan brotes y muestran resistencia a múltiples clases de antifúngicos, lo que dificulta la prevención y el control. Se observa una marcada variación regional, con mayores proporciones de C. tropicalis en Asia, C. parapsilosis en el sur de Europa y Latinoamérica, y un aumento de los informes de C. auris en el sur de Asia y Oriente Medio. C. tropicalis, frecuentemente asociada a neutropenia, malignidad y alta mortalidad, presenta una resistencia cada vez mayor a los azoles, especialmente en países de ingresos bajos y medios, donde el fluconazol suele ser el fármaco de primera línea.
La secuenciación molecular ha reasignado varias especies históricamente agrupadas como Candida spp. a nuevos géneros, alineando la nomenclatura con la filogenia. Clínicamente, estos cambios alteran la nomenclatura en lugar del manejo del paciente. Los patrones de resistencia intrínseca, los puntos de corte y las recomendaciones de las guías se mantienen sin cambios, por lo que las opciones terapéuticas no cambian únicamente con los nuevos nombres. El impacto práctico es operativo: los laboratorios de microbiología, las bibliotecas de espectrometría de masas de tiempo de vuelo con desorción láser asistida por matriz (MALDI-TOF), los paneles de reacción en cadena de la polimerasa (PCR), los sistemas de información de laboratorio (SIL), las historias clínicas electrónicas (HCE), los antibiogramas y las alertas de gestión deben mapear los nombres antiguos y nuevos para mantener la continuidad de los informes y el apoyo a la toma de decisiones. Se espera que la mayoría de los laboratorios realicen una transición gradual y utilicen la doble notificación durante un tiempo para evitar confusiones mientras se actualizan los sistemas de vigilancia y las directrices (véase la Tabla 1).
Nombre anterior (familiar) |
Nuevo género/nombre actualizado |
Candida glabrata |
Nakaseomyces glabratus |
Candida krusei |
Pichia kudriavzevii |
Candida kefyr |
Kluyveromyces marxianus |
Candida lusitaniae |
Clavispora lusitaniae |
Candida parapsilosis |
Pichia parapsilosis |
Candida guilliermondii |
Meyerozyma guilliermondii |
Candida rugosa |
Diutina rugosa |
Tabla 1. Nomenclatura actualizada de Candida ssp. comunes.
Con frecuencia se citan múltiples intervenciones relacionadas con la UCI como factores de riesgo para la CI, incluyendo ingresos prolongados, cateterización venosa central, antibióticos de amplio espectro, nutrición parenteral, terapia de reemplazo renal y cirugías mayores, particularmente del tracto gastrointestinal. Sin embargo, aunque estas asociaciones son bien conocidas, su riesgo atribuible es difícil de cuantificar. Estos factores a menudo se superponen y reflejan la gravedad de la enfermedad subyacente, lo que limita su valor predictivo independiente. Por lo tanto, las tablas tradicionales que enumeran los factores de riesgo, aunque comunes en la literatura, tienen una utilidad clínica limitada y pueden simplificar excesivamente la compleja dinámica huésped-patógeno en pacientes críticos. Las guías consideran las puntuaciones de predicción de riesgo para la CI como herramientas simples y de bajo costo a pie de cama para estimar la probabilidad preprueba y frenar el sobretratamiento. Su principal valor es un alto valor predictivo negativo, que ayuda a identificar a los pacientes en los que los antifúngicos empíricos pueden suspenderse de forma segura. Una puntuación alta no debe ser la única base para el tratamiento. Las puntuaciones deben utilizarse para impulsar un muestreo selectivo, y solo cuando el cuadro clínico sugiera una enfermedad invasiva, se debe iniciar el tratamiento empírico cuidadosamente planificado, con una reevaluación temprana y la interrupción del tratamiento según corresponda. Es importante destacar que las puntuaciones están diseñadas para complementar, no para reemplazar, el juicio clínico.
El panorama inmunitario de los pacientes de la UCI también se ha vuelto más complejo. La CI suele presentarse tras una sepsis bacteriana, y la recuperación de la sepsis incluye un período de inmunoparálisis. Por lo tanto, el estado inmunitario de los pacientes cambia con el tiempo en la UCI. Además, muchos pacientes críticos están expuestos a múltiples líneas de terapia inmunosupresora que afectan distintas vías inmunitarias. Esto incluye a pacientes con neoplasias hematológicas, receptores de trasplantes alogénicos de células madre, receptores de terapia CAR T y aquellos que reciben otros agentes inmunosupresores novedosos en hematología, oncología, gastroenterología, reumatología y medicina de trasplantes. La inmunosupresión resultante suele ser multifactorial, alterando tanto la respuesta inmunitaria innata como la adaptativa de forma heterogénea y dinámica, lo que aumenta la vulnerabilidad a las infecciones fúngicas.
Avances en los enfoques diagnósticos
El diagnóstico preciso y oportuno de la CI en la UCI sigue siendo difícil. El cultivo sigue siendo la referencia para la confirmación; sin embargo, la sensibilidad suele ser baja, con frecuencia inferior al 40 %, sobre todo en casos de enfermedad profunda o tras la exposición a antifúngicos, y el tiempo hasta la positividad puede tardar días. La MALDI-TOF agiliza la identificación de las especies una vez que los cultivos son positivos, pero aún depende del crecimiento viable y no puede sustituir a las pruebas de sensibilidad a los antifúngicos (AFST). La AFST directa del sobrenadante de hemocultivos positivos puede acortar el camino hacia el perfil de resistencia y ayudar a orientar el tratamiento de forma más temprana. Muchos ensayos moleculares y serológicos se desarrollaron y validaron principalmente para la candidemia, y su rendimiento en la UCI, donde la enfermedad no candidémica es frecuente, se reduce aún más en pacientes que reciben profilaxis antifúngica o terapia subóptima (por ejemplo, exposición inadecuada al fármaco o exposición previa a azoles que reduce la sensibilidad), lo que contribuye a un diagnóstico insuficiente y al retraso terapéutico.
Entre los ensayos sin cultivo, el (1 → 3)-β-d-glucano (BDG) es el biomarcador panfúngico más utilizado. Su principal limitación en enfermedades críticas es el riesgo de falsos positivos, que pueden surgir de la translocación intestinal en sepsis grave, enfermedad hepática avanzada, hemodiálisis o contacto con materiales quirúrgicos como gasas. Aplicado adecuadamente, el BDG es más valioso como una herramienta de descarte, apoyando la interrupción impulsada por la administración de la terapia antifúngica empírica innecesaria (Tabla 2). No obstante, el BDG ha demostrado consistentemente un alto valor predictivo negativo (VPN) para la candidiasis invasiva (CI), lo que lo hace más útil como una herramienta de descarte para apoyar la interrupción temprana de los antifúngicos empíricos en pacientes de la UCI cuando disminuye la sospecha (Tabla 2). Reflejando esto, las recientes directrices ECMM/ISHAM/ASM desaconsejan su uso para el inicio del tratamiento. Los metanálisis y los estudios de cohorte de la UCI confirman además el sólido desempeño de la BDG para descartar la enfermedad, con un límite de corte de 80 pg/mL que a menudo se aplica para limitar la exposición innecesaria a las equinocandinas.
Herramienta |
Tiempo respuesta |
Fortalezas |
Limitaciones |
Papel en la UCI |
Cultivo de sangre |
2–5 días |
Estándar de oro, identificación de especies |
Lento, insensible en pacientes pretratados |
Envía siempre, pero no es confiable solo |
BDG (1,3)-β-d-glucano |
Horas |
VPN alto, ayuda a detener la terapia |
Falsos positivos (IVIG, hemodiálisis), baja especificidad |
Apoyar la interrupción de la terapia empírica |
Manano/antimanano |
Horas |
Útil con BDG |
Sensibilidad variable |
Uso complementario |
T2Candida |
< 5 h |
Detecta especies comunes, rápida |
Panel limitado, costo |
Herramienta de reglamentación rápida |
PCR |
< 1 día |
Alta sensibilidad |
Detecta ADN de levadura muerta |
Apoya la iniciación temprana |
MALDI-TOF |
< 1 día |
Identificación rápida de especies a partir de colonias |
Requiere crecimiento cultural |
Acelera la terapia dirigida |
Tabla 2. Descripción general de cultivo, BDG, PCR, T2 y MALDI-TOF con tiempo de respuesta y limitaciones
Otros marcadores serológicos, como el antígeno manano, los anticuerpos antimanano y el anticuerpo del tubo germinal de Candida albicans, pueden proporcionar señales de identificación de especie, pero su sensibilidad es limitada, especialmente para Candida no albicans spp., y no deben utilizarse de forma aislada para iniciar el tratamiento. Los métodos moleculares, como la PCR y la secuenciación de nueva generación (NGS) en sangre o tejido, ofrecen una mayor sensibilidad analítica y la capacidad de detectar múltiples especies, incluidas infecciones mixtas. Sin embargo, su adopción clínica más amplia se ve limitada por la estandarización de los ensayos, el coste y los plazos de entrega variables. Candida T2 puede detectar candidemia rápidamente y ayudar a identificar casos complicados; sin embargo, su uso rutinario se ha visto limitado por barreras financieras y de implementación. Cuando se sospecha CI en sitios compartimentales, como una infección intraabdominal, el muestreo dirigido mejora el rendimiento diagnóstico; la BDG en líquido peritoneal ha mostrado mayor sensibilidad y especificidad que la BDG sérica para la candidiasis intraabdominal, pero los umbrales no están estandarizados y los resultados deben interpretarse con cautela. Estas realidades a nivel de prueba respaldan una vía pragmática, alineada con la administración, en lugar de depender de una sola modalidad. Ante la primera sospecha clínica, los médicos deben obtener hemocultivos pareados, tomar muestras de focos probables, como líquido peritoneal, y considerar la BDG y, cuando estén disponibles, pruebas moleculares de sangre y muestras específicas del sitio. El tratamiento antifúngico empírico se reserva mejor para pacientes con choque séptico o perfiles de muy alto riesgo, con un punto temporal de reevaluación documentado. Dentro de las 24 a 48 h, se deben integrar los resultados y la trayectoria clínica. Cuando la BDG es negativa y no surge evidencia que corrobore la infección por Candida o Aspergillus spp., es apropiado suspender la equinocandina empírica. Cuando la BDG es positiva, se deben revisar los posibles contextos de falsos positivos y la evidencia de infección por Pneumocystis o Aspergillus spp. antes de intensificar el tratamiento. Si los cultivos se vuelven positivos, la MALDI-TOF y la AFST directa deben guiar el tratamiento dirigido a la especie. La preocupación persistente a pesar de los análisis de sangre negativos, especialmente en presencia de una fuente plausible, debe motivar el diagnóstico y la obtención de imágenes dirigidas al sitio. El control de la fuente, incluyendo la extracción o el drenaje de dispositivos endovasculares, debe realizarse en paralelo, y las decisiones deben tomarse en un grupo multidisciplinario de la UCI que incluya cuidados intensivos, enfermedades infecciosas, microbiología y farmacia. Consulte la Tabla 2 para ver los tiempos de respuesta comparativos, las ventajas y las limitaciones de cada prueba.
Los errores comunes incluyen iniciar el tratamiento con antifúngicos basándose únicamente en la positividad de BDG sin correlación clínica, basarse únicamente en análisis de sangre cuando se sospecha una infección compartimental y tratar la identificación de la especie como un indicador indirecto de la susceptibilidad a pesar de la necesidad de AFST y la posibilidad de que la farmacocinética en el sitio santuario pueda desvincular la CMI de la respuesta. Un enfoque sencillo se puede ver en la Fig. 1.
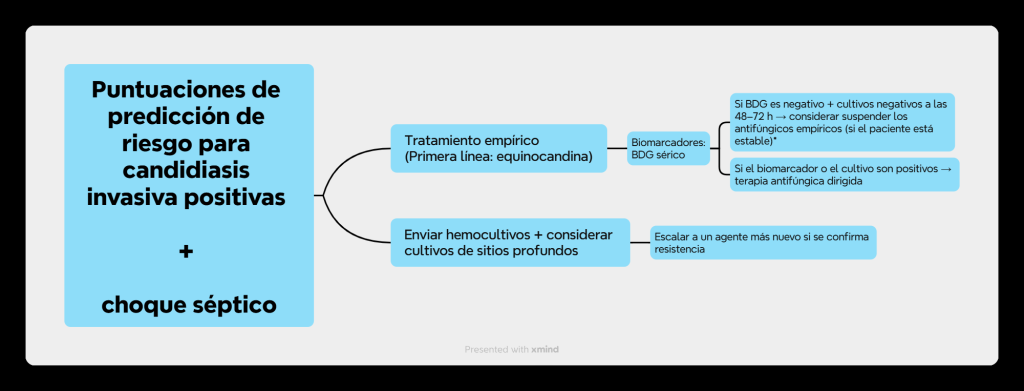
En conjunto, una estrategia de diagnóstico multimodal específica de la UCI que integra métodos basados en cultivos, biomarcadores específicos, ensayos moleculares y reevaluación estructurada ofrece la mejor oportunidad de equilibrar un tratamiento temprano apropiado con una desescalada temprana segura, alineando la práctica de diagnóstico con los principios de administración de antimicóticos.
Tendencias de resistencia y susceptibilidad a los antifúngicos
La resistencia a los antifúngicos es un desafío creciente en las UCI, impulsado por la exposición previa a antifúngicos, la propagación clonal de patógenos resistentes, el retraso en el reconocimiento y la complejidad farmacológica de las enfermedades críticas. El acceso a agentes de amplio espectro, como las equinocandinas, es inconsistente; incluso donde existen genéricos, su uso puede verse limitado por el costo y la inestabilidad del suministro. Las formulaciones lipídicas de anfotericina B son la forma preferida de anfotericina B; sin embargo, su forma desoxicolato convencional sigue siendo una alternativa en entornos con recursos limitados, pero la nefrotoxicidad y la baja tolerabilidad complican su uso.
Los patrones de especies ilustran amenazas específicas. C. glabrata (Tabla 3) es altamente adaptativa, con múltiples vías de resistencia y propensión a desarrollar panresistencia bajo presión farmacológica, de forma análoga al comportamiento adaptativo de Pseudomonas aeruginosa en bacterias. C. auris se comporta más como Acinetobacter baumannii, no por su virulencia intrínseca sino debido a su persistencia ambiental, tolerancia a los desinfectantes y rápida propagación en los centros de atención de la salud (véase la Tabla 4).
Mecanismo |
Impacto funcional |
Los antifúngicos son los más afectados |
Incidencia reportada (rangos ilustrativos*) |
Ganancia de función de PDR1 (especialmente C. glabrata) |
La sobreexpresión de las bombas de eflujo CDR1, CDR2, SNQ2 → redujo los niveles intracelulares del fármaco |
Azoles (fluconazol, voriconazol, posaconazol, isavuconazol) |
La resistencia a los azoles entre los aislados del torrente sanguíneo de C. glabrata suele ser del 10 al 30 %; las mutaciones PDR1 están presentes en la mayoría de los aislados resistentes a los azoles. |
Mutaciones de puntos calientes FKS1/FKS2 |
Alteración de la β-1,3-glucano sintasa → disminución de la unión al fármaco |
Equinocandinas (caspofungina, micafungina, anidulafungina, rezafungina) |
Resistencia a las equinocandinas: C. glabrata 3–10% en general, mayor en algunos centros; otras especies <1–2% pero reportadas |
Formación de biopelículas |
Matrix limita la penetración y promueve la tolerancia y la persistencia en los dispositivos |
Mayor impacto en azoles y polienos; las equinocandinas conservan su actividad pero pueden ser menos efectivas dentro de biopelículas maduras |
La candidemia asociada a dispositivos es común; el fenotipo de biopelícula es frecuente entre los aislamientos clínicos involucrados en la infección de dispositivos endovasculares o prótesis. |
Síntesis de esteroles alterada (p. ej., sobreexpresión/mutación de ERG11; defectos de ERG3) |
Reducción de la unión al objetivo de azol o elusión de intermediarios de esteroles tóxicos |
Principalmente azoles; la pérdida de ERG3 puede reducir la susceptibilidad a la anfotericina B |
Resistencia a los azoles debido a cambios en la vía ERG: poco común en C. albicans, variable en C. parapsilosis y C. tropicalis; los puntos críticos informan de una resistencia al fluconazol del 10 al 30 % en C. parapsilosis |
Disfunción mitocondrial (mutantes “petite”, vías GOA1) |
Respuesta global al estrés con regulación positiva del eflujo y cambios en la membrana → fenotipo multifármaco |
Principalmente azoles y a veces polienos; efecto de las equinocandinas variable. |
Rare in routine clinical isolates, described sporadically in outbreaks or salvage settings |
Tabla 3. Mecanismo de resistencia de C. glabrata. PDR1 Resistencia a fármacos pleiotrópicos 1 (bombas de eflujo que regulan factores de transcripción); CDR1, CDR2 Transportadores de resistencia a fármacos de Candida 1 y 2 (bombas de eflujo de casete de unión a ATP); SNQ2 Transportador de eflujo de múltiples fármacos (familia ABC); FKS1/FKS2 Genes que codifican la β-1,3-glucano sintasa (diana de las equinocandinas); ERG11 Gen que codifica la lanosterol 14-α-desmetilasa (enzima diana de los azoles); ERG3 Gen que codifica la esterol C-5 desaturasa (implicada en la biosíntesis de esteroles).
Estrategia |
Objetivo |
Culturas de vigilancia activa* |
Identificar pacientes colonizados |
Precauciones de contacto |
Prevenir la transmisión en UCI con múltiples camas |
Equipo y personal dedicado |
Evitar la contaminación cruzada entre pacientes |
Descontaminación de fregaderos y desagües |
Interrumpir los reservorios ambientales |
Agentes de limpieza esporicidas |
Reducir la contaminación de la superficie |
Cohorte de pacientes |
Limitar la exposición a otros pacientes y la contaminación cruzada |
Rastreo de brotes |
Identificar y aislar redes de transmisión |
Tabla 4. Estrategias de control de infecciones para C. auris. Las medidas básicas (higiene de manos, precauciones de contacto, descontaminación de equipos y ambiente, y detección dirigida) también son aplicables a otras especies de Candida, incluida C. tropicalis resistente a los azoles; sin embargo, la persistencia ambiental y el perfil de tolerancia a los desinfectantes que motivan protocolos mejorados son los más característicos de C. auris.* para pacientes de alto riesgo (p. ej., estadía prolongada en UCI, cirugía abdominal, oxigenación por membrana extracorpórea [ECMO])
Paralelamente, las cepas de C. parapsilosis resistentes al fluconazol, en particular aquellas con la sustitución Erg11p Y132F, están cada vez más implicadas en brotes clonales en UCI y también pueden persistir en el entorno, especialmente donde los recursos para el control de infecciones son limitados.
La prueba de AFST se realiza de forma desigual, a menudo con retraso y se ve obstaculizada por el acceso limitado a métodos de referencia, la validación imperfecta de los procedimientos comerciales y una correlación débil entre las CMI y los resultados en infecciones relacionadas con biopelículas o de larga data. La AFST verdaderamente rápida y a pie de cama rara vez está disponible. Cuando es posible, la prueba directa de hemocultivos positivos mediante tiras de difusión en gradiente de plástico puede acortar el tiempo de obtención de resultados y ha demostrado una buena concordancia con los métodos estándar. La detección molecular de mutaciones de resistencia proporciona una vía rápida adicional para identificar aislamientos resistentes.
La optimización del uso de antifúngicos es fundamental para mejorar los resultados. Los programas que combinan el diagnóstico temprano con puntos de decisión predefinidos facilitan una declaración y una descarte más rápidas, una terapia precoz dirigida a la especie y una reducción de la exposición innecesaria, lo que resulta en reducciones consistentes en el uso de antifúngicos, los costos, la mortalidad y la duración de la estancia hospitalaria sin daños. La implementación suele verse limitada por el acceso desigual a las pruebas rápidas y la monitorización de fármacos terapéuticos (MFT), la capacidad del personal y la coordinación inconsistente entre la UCI, las enfermedades infecciosas, el departamento de microbiología y la farmacia. Las prioridades incluyen ampliar el acceso al diagnóstico rápido y la MFT, integrar protocolos compartidos y adoptar un enfoque de gestión económica que sopesa los mayores costos de adquisición de los nuevos agentes frente al valor clínico, la prevención de resistencias y la sostenibilidad del sistema en la atención urgente en la UCI.
La candidemia persistente se define como la recuperación continua de Candida spp. en hemocultivos durante ≥5 días a pesar de la terapia antifúngica adecuada y el control adecuado de la fuente de infección. Con mayor frecuencia, refleja un reconocimiento tardío, una exposición subterapéutica al fármaco (p. ej., durante el soporte extracorpóreo, obesidad o hipoalbuminemia) o un control inadecuado de la fuente, más que una verdadera resistencia. Por el contrario, la candidemia irruptiva se refiere a una infección del torrente sanguíneo por Candida que ocurre mientras el paciente ya recibe terapia antifúngica sistémica, a la cual la cepa aislada normalmente se consideraría susceptible. Esto puede indicar resistencia adquirida (p. ej., mutaciones de FKS), infección con una especie intrínsecamente resistente o una exposición insuficiente al fármaco, y debe distinguirse de la persistencia para asegurar un manejo adecuado. La Tabla 5 describe un enfoque estructurado para estas entidades. Sin embargo, en pacientes críticos, el fracaso frecuentemente refleja un reconocimiento tardío, una farmacocinética alterada con ECMO o terapia de reemplazo renal continuo (TRRC), o especialmente un control inadecuado de la fuente. Las llamadas infecciones irruptivas a menudo surgen de estos factores relacionados con el sistema, más que de una verdadera resistencia microbiológica. Abordar tanto la persistencia como la resistencia requiere una mayor precisión diagnóstica, una vigilancia confiable, un control riguroso de la fuente y un manejo multidisciplinario coordinado que integre la experiencia farmacológica, microbiológica y clínica.
Dominio |
Acciones clave |
1. Control de fuente |
Retirar/cambiar dispositivos endovasculares Manejo de infecciones profundas (p. ej., endocarditis): procedimiento quirúrgico ± tratamiento antifúngico Sospecha de biopelícula → Anfotericina B liposomal Si la positividad persiste tras el control de la fuente → considerar terapia combinada en casos refractarios |
2. Terapia antifúngica |
Verificar la dosificación adecuada Revisar las interacciones farmacológicas Considerar los efectos de la ECMO/TRRC Realizar TDM Si se desarrolla candidemia persistente durante el tratamiento con anfotericina B liposomal:
|
3. Monitoreo microbiológico |
Repetir hemocultivos Monitorear el aclaramiento |
4. Prueba de resistencia |
Realizar prueba de resistencia a fármacos (AFST) (buscar cepas resistentes a azoles, equinocandinas o multirresistentes). Si se confirma la resistencia *→ cambiar a un antifúngico alternativo/emergente. Si la terapia es adecuada + control de la fuente, pero el resultado sigue siendo positivo, → considerar la terapia antifúngica combinada en casos refractarios. |
Tabla 5. Acciones clave en el manejo de la candidemia persistente. Pruebas de sensibilidad a antifúngicos (AFST); TRC (Terapia de reemplazo renal continuo); ECMO (Oxigenación por membrana extracorpórea); Resistencia a la radiación; Monitorización farmacoterapéutica (TDM). *Las pruebas de resistencia deben incluir la detección de mutaciones en FKS1/FKS2 (β-1,3-D-glucano sintasa, resistencia a equinocandinas) y mutaciones en ERG11 (lanosterol 14-α-desmetilasa, resistencia a azoles).
Manejo clínico y antifúngicos de próxima generación
En este manuscrito, utilizamos terminología precisa para evitar ambigüedades. La profilaxis se refiere al uso de antifúngicos en pacientes de alto riesgo sin sospecha de infección. La terapia preventiva se inicia sobre la base de la colonización, la detección de biomarcadores o los hallazgos de imágenes en ausencia de aislamiento de cultivo. La terapia empírica es un curso corto basado en el riesgo que se inicia para la sospecha de candidiasis invasiva (CI) mientras están pendientes los diagnósticos definitivos. La terapia dirigida se guía por la identificación del patógeno +/−AFST. Aunque la práctica anterior en muchos centros favorecía comenzar la terapia antifúngica definitiva solo después de la confirmación del cultivo, con el tratamiento empírico o preventivo reservado para pacientes de alto riesgo seleccionados, la evidencia actual muestra que los retrasos en el inicio de la terapia apropiada se asocian con peores resultados. En consecuencia, las pautas de expertos respaldan la terapia empírica temprana y apropiada para la sospecha de CI en pacientes con enfermedad grave o choque séptico, realizada mientras se busca urgentemente la confirmación microbiológica. En la práctica, esto representa un enfoque basado en el riesgo, guiado por herramientas de estratificación específicas de la UCI y complementado con un plan de administración predefinido para la reevaluación y la desescalada, similar a la administración de antimicrobianos en la sepsis, que incluye la interrupción inmediata cuando los resultados del diagnóstico no respaldan la CI.
El fluconazol se ha utilizado ampliamente históricamente como tratamiento empírico, especialmente en regiones con baja prevalencia de resistencia a los azoles. Sin embargo, las guías actuales recomiendan cada vez más las equinocandinas como tratamiento de primera línea en pacientes críticos. Las opciones antifúngicas siguen siendo limitadas, y en la UCI, las equinocandinas son la base del tratamiento inicial y empírico. Sin embargo, su eficacia puede verse limitada por una penetración subóptima en zonas santuario (sistema nervioso central, peritoneo, tracto urinario, tejidos oculares), la variabilidad farmacocinética en la enfermedad crítica y la aparición de resistencias, especialmente en C. glabrata. Estos desafíos se agravan en infecciones compartimentales (p. ej., candidiasis peritoneal, endocarditis por Candida, endoftalmitis) y durante el soporte extracorpóreo, como la ECMO o la terapia de reemplazo renal continuo (TRRC), donde la alteración del volumen de distribución, la adsorción a los circuitos y otras pérdidas relacionadas con los circuitos pueden reducir la exposición y la eficacia. Dado el riesgo de infradosificación, especialmente en pacientes que reciben soporte extracorpóreo, con hipoalbuminemia grave u obesidad mórbida, se recomienda el uso de la monitorización farmacoterapéutica de fármacos (MTF), cuando esté disponible, para optimizar la dosificación de antifúngicos. Esto no debe considerarse un estándar universal, ya que agentes como la rezafungina tienen un perfil farmacocinético específico que podría no requerir dicha monitorización.
Una consideración adicional e importante es el papel de la anfotericina B liposomal en pacientes que no mejoran con el tratamiento con equinocandinas. Las directrices actuales de la ECMM/ISHAM/ASM recomiendan encarecidamente este agente en estos casos, dada su amplia gama de efectos fungicidas y su fiable actividad. La anfotericina B liposomal es especialmente relevante en localizaciones difíciles de tratar, como la candidiasis peritoneal, donde la penetración de las equinocandinas puede ser subóptima y los resultados clínicos son deficientes si el tratamiento se retrasa o es inadecuado. Es crucial destacar esta función establecida antes de centrarse en los nuevos agentes antifúngicos, ya que la anfotericina B sigue siendo una opción de rescate fundamental en la UCI.
A pesar de los prometedores datos preclínicos, los desafíos farmacológicos reales en pacientes críticos, como la distribución alterada de fármacos y la desregulación inmunitaria, a menudo limitan la eficacia antifúngica. Esto subraya la necesidad de estrategias como la monitorización terapéutica de fármacos (MTF), que siguen infrautilizadas en la práctica clínica en la UCI.
Reconociendo estas limitaciones, se están desarrollando varios agentes antifúngicos en investigación para superar estas barreras específicas de la UCI. Rezafungina, una equinocandina de nueva generación con dosificación intravenosa una vez a la semana, alcanza concentraciones plasmáticas sostenidas y un perfil farmacocinético de alta concentración que puede mejorar la eliminación temprana de hongos y mantener los niveles del fármaco en pacientes críticos con farmacocinética alterada. Su larga vida media reduce la necesidad de acceso frecuente a vías, lo que disminuye el riesgo de complicaciones relacionadas con el catéter y facilita el flujo de trabajo en la UCI. Al aumentar la probabilidad de negatividad temprana del cultivo y facilitar las transiciones simplificadas a la atención ambulatoria o de cuidados intermedios, rezafungina ofrece ventajas tanto terapéuticas como operativas en el manejo de la CI. Sin embargo, se necesitan más datos en pacientes críticos.
Fosmanogepix (APX001) es un antifúngico de primera clase dirigido a Gwt1, con actividad de amplio espectro contra Candida spp., incluyendo cepas resistentes a equinocandinas. Su disponibilidad tanto en formulaciones intravenosas (IV) como orales lo hace especialmente atractivo para pacientes de UCI, ofreciendo flexibilidad para quienes tienen acceso intravenoso limitado o durante la terapia de descenso. Aunque inicialmente se estudió en enfermedades invasivas causadas por mohos, datos recientes de fase 2 en pacientes no neutropénicos con candidemia informaron una tasa de éxito del tratamiento del 80% y una supervivencia a los 30 días del 85%, con buena tolerabilidad. Actualmente se está llevando a cabo un ensayo de fase 3 centrado específicamente en la candidemia invasiva (CI), lo que refuerza el papel potencial de fosmanogepix en las estrategias antifúngicas en cuidados intensivos.
Ibrexafungerp, el primer inhibidor oral de la glucano sintasa, muestra actividad contra Candida spp. resistentes tanto a los azoles como a las equinocandinas. Aunque su uso actual en UCI es limitado debido a la ausencia de una formulación IV, ha demostrado ser prometedor como terapia de rescate en la candidemia. Se está evaluando para un tratamiento de reducción gradual en un ensayo de fase 3. Cabe destacar su relevancia en la UCI: datos in vitro recientes muestran que ibrexafungerp conserva su actividad contra algunos aislados de Candida resistentes a las equinocandinas, en particular C. glabrata, incluyendo aquellos con mutaciones FKS asociadas a la resistencia, y C. auris.
Rezafungina, fosmanogepix e ibrexafungerp representan actualmente los fármacos más prometedores para pacientes con CI en la UCI, dada su actividad contra cepas resistentes y su posible integración en los protocolos hospitalarios y las recomendaciones de las guías clínicas recientes.
Terapia combinada en UCI para CI
La terapia antifúngica combinada no es una estrategia de rutina para la CI en la UCI. La evidencia se basa principalmente en estudios observacionales, por lo que cualquier posible ventaja debe sopesarse con los riesgos reales, como la toxicidad aditiva, las interacciones farmacológicas clínicamente relevantes y la exposición innecesaria a agentes de amplio espectro. En este contexto, la terapia combinada debe considerarse una intervención dirigida y no un enfoque estándar.
Sin embargo, existen escenarios específicos en los que se justifica un tratamiento corto y cuidadosamente supervisado. Estos incluyen endocarditis confirmada o con sospecha sólida, candidiasis renal obstruida, afectación ocular o del sistema nervioso central, y casos con una carga fúngica persistentemente alta o candidemia en curso a pesar del control de la fuente. La terapia combinada también puede ser razonable cuando se sospecha o confirma resistencia, o cuando la farmacocinética es muy incierta o la TDM se retrasa, por ejemplo, en pacientes que reciben ECMO o TRRC o en aquellos con obesidad marcada e interacciones farmacológicas complejas. Cuando se utiliza una combinación, las combinaciones más comunes son una equinocandina con un azol o una equinocandina con anfotericina B liposomal. La flucitosina puede añadirse para la endocarditis o la enfermedad del sistema nervioso central debido a su penetración favorable. Sin embargo, el acceso, las citopenias y la necesidad de monitorización suelen limitar su uso. En situaciones donde la resistencia a las equinocandinas es preocupante, como las infecciones causadas por C. glabrata o C. auris, una terapia combinada inicial puede proporcionar cobertura. Al mismo tiempo, se busca un AFST urgente y un control definitivo de la fuente.
En términos operativos, cualquier combinación debe comenzar con una reevaluación predefinida de 48 a 72 horas que incorpore un AFST rápido, evaluación de la exposición al fármaco y una TDM temprana para los azoles, considerando la monitorización de las equinocandinas cuando la absorción, el soporte extracorpóreo, la obesidad o un fallo inexplicable sean motivo de preocupación. La desescalada a la monoterapia más eficaz debe realizarse tan pronto como se asegure el control de la fuente y el diagnóstico aclare la identidad y la susceptibilidad del patógeno. En resumen, la terapia combinada no debe utilizarse de forma rutinaria; debe reservarse para las indicaciones específicas (Tabla 6), seleccionadas entre los pares de regímenes descritos, y complementarse con una reevaluación temprana, la TDM y una desescalada oportuna. Se necesitan ensayos mejor diseñados y mejores herramientas predictivas antes de una adopción más amplia.
Escenario clínico |
Combinación inicial preferida |
Objetivo principal de la combinación |
Complementos clave |
Reevaluación y desescalada |
Prioridades de TDM y PK |
Endocarditis (nativa o protésica) |
Anfotericina B liposomal + flucitosina, o equinocandina + azol cuando la anfotericina B o la flucitosina no son adecuadas |
Exposición rápida a fungicidas y penetración en el SNC/vegetación |
Consulta quirúrgica temprana para cirugía valvular cuando esté indicada; control de origen de dispositivos intravasculares |
Reevaluar a las 48-72 h, reducir a monoterapia dirigida una vez que se conozcan las especies y la susceptibilidad y se logre el control de la cirugía/fuente |
TDM para azoles; considerar la variabilidad farmacocinética con disfunción renal y CRRT |
Afectación del SNC (meningitis, ventriculitis) |
Anfotericina B liposomal + flucitosina; reducir gradualmente a fluconazol en dosis alta si es susceptible |
Penetración del LCR y esterilización temprana |
Quitar o cambiar el hardware neuroquirúrgico si es posible |
Reevaluar a las 48-72 h, reducir la dosis cuando se hayan definido el patógeno y las susceptibilidades y el LCR se haya aclarado. |
Monitoreo del nivel de flucitosina cuando esté disponible; TDM azólico para reducción gradual |
Enfermedad ocular (endoftalmitis) |
Azole sistémico (voriconazol o fluconazol según la especie) + anfotericina B liposomal; considerar un tratamiento corto con equinocandina solo como puente |
Lograr niveles intraoculares terapéuticos y una rápida eliminación del organismo. |
Terapia intravítrea y vitrectomía temprana según oftalmología |
Reevaluar a las 48-72 h, adaptar a la especie y la respuesta ocular; pasar a monoterapia cuando esté estable |
Azole TDM; obsérvese la escasa penetración ocular de las equinocandinas |
Candidiasis renal con obstrucción |
Equinocandina + azol, o anfotericina B liposomal + flucitosina si existe preocupación por la resistencia a los azoles |
Cobertura durante el alivio de la obstrucción y alta carga fúngica |
Control urgente de la fuente: stent o nefrostomía; retirar dispositivos colonizados |
Reevaluar a las 48-72 h después del drenaje, reducir la dosis una vez que la mejoría clínica y los datos del cultivo lo respalden. |
TDM de azol; considere cambios farmacocinéticos con modalidades de soporte renal |
Candidemia persistente o carga fúngica muy alta a pesar del control de la fuente |
Equinocandina + azol, o equinocandina + anfotericina B liposomal |
Ampliar la exposición mientras se espera una prueba rápida de susceptibilidad |
Intensificar la búsqueda de focos ocultos; retirar dispositivos intravasculares |
Reevaluar a las 48-72 h, limitar a un solo agente activo una vez que la AFST regrese y se verifique el control de la fuente |
TDM de azol; considere los problemas de exposición a equinocandinas en ECMO |
Resistencia sospechada o probada (por ejemplo C. glabrata, C. auris) |
Equinocandina + anfotericina B liposomal en espera de AFST |
Garantizar la actividad contra la posible resistencia a las equinocandinas o a los azoles. |
AFST temprana, incluidos marcadores moleculares cuando estén disponibles |
Reevaluar a las 48-72 h, reducir a monoterapia activa tan pronto como las susceptibilidades sean claras |
Azole TDM; ajustar por disfunción orgánica y soporte extracorpóreo |
Incertidumbre farmacocinética importante o TDM retrasada (ECMO, CRRT, obesidad mórbida, interacciones complejas) |
Equinocandina temporal + azol mientras se confirma la exposición |
Mitigar el riesgo de subexposición durante las primeras 48 a 72 horas |
Prompt TDM setup and drug interaction review |
Reevaluar a las 48-72 h cuando el TDM esté disponible, reducir la dosis una vez confirmadas las exposiciones objetivo |
TDM para azoles; considerar el monitoreo de equinocandinas cuando esté disponible |
Candidemia de rutina con eliminación rápida, aislamiento susceptible y control de la fuente |
Combinación no indicada; utilice un solo agente activo según las pautas |
Evite la exposición, la toxicidad y los costos innecesarios |
Retirar los dispositivos endovasculares y buscar el control de la fuente |
N / A |
TDM si toma azoles y riesgo de interacciones o malabsorción |
Tabla 6. Estrategias combinadas para infecciones refractarias profundas y difíciles. SNC Sistema nervioso central; LCR Líquido cefalorraquídeo; ECMO Oxigenación por membrana extracorpórea; TRRC Terapia de reemplazo renal continuo; Farmacocinética farmacocinética; TDM Monitorización terapéutica de fármacos; AFST Prueba de sensibilidad a los antifúngicos. La terapia combinada no es rutinaria. Resérvela para los escenarios específicos anteriores, comience con una reevaluación predefinida de 48 a 72 h, obtenga pruebas de sensibilidad tempranas, realice TDM para azoles y considérelo para equinocandinas en entornos farmacocinéticos complejos, y desescale a la monoterapia efectiva más estrecha tan pronto como sea posible. En resumen, evite las combinaciones concurrentes rutinarias de anfotericina B-azol para Candida spp. a menos que haya una razón de rescate convincente; prefiera pares alternativos (p. ej., equinocandina + azol) si se necesita terapia combinada. Si cambia de un azol a anfotericina B, tenga en cuenta los posibles efectos de arrastre; Si se pasa de anfotericina B a un azol, mantenga la superposición breve.
Direcciones futuras en la candidiasis en la UCI: innovación, gestión y valor
Se espera que la innovación a corto plazo en candidiasis en UCI impulse tres cambios pragmáticos. En primer lugar, los diagnósticos se consolidarán en paquetes de ingreso y descarte más rápidos que combinan biomarcadores séricos y compartimentales, como la BDG peritoneal, la identificación rápida de especies, la AFST en placa o rápida, y la NGS, para marcadores de resistencia y seguimiento de brotes, con puntuaciones de riesgo en la historia clínica electrónica que activan decisiones predefinidas de inicio, parada y cambio. En segundo lugar, la optimización de la exposición se facilitará mediante el micromuestreo a pie de cama, la TDM en el punto de atención para azoles, la dosificación precisa basada en modelos que considera el soporte extracorpóreo y la obesidad, y calculadoras de dosificación que consideran las pérdidas del circuito. En tercer lugar, la terapéutica se ampliará con equinocandinas de acción prolongada y nuevos agentes orales que conservan su actividad contra especies de Candida resistentes, incluyendo C. glabrata resistente a la equinocandina, C. parapsilosis resistente a los azoles y C. auris, lo que debería permitir una reducción gradual más temprana y vías de alta más seguras. La rezafungina, una equinocandina de administración semanal, ejemplifica este cambio al ofrecer la posibilidad de reducir la manipulación de las vías respiratorias, la carga de trabajo de enfermería y la duración de la estancia hospitalaria, a la vez que permite el manejo ambulatorio en pacientes seleccionados. En conjunto, estos avances están posicionados para reforzar la atención concordante con las guías clínicas al priorizar una equinocandina como terapia de primera línea con control temprano de la fuente. También respaldan el uso de biomarcadores para suspender la terapia empírica cuando disminuye la probabilidad preprueba, permiten una rápida focalización una vez disponibles los datos de susceptibilidad y resistencia, permiten ciclos de tratamiento más cortos después del control de la fuente e integran los puntos de control de la administración en el flujo de trabajo rutinario de la UCI.
A medida que se amplía el arsenal antifúngico, también lo hace su complejidad clínica y económica. Los agentes con actividad de amplio espectro, incluidos aquellos que se dirigen tanto a levaduras como a mohos, pueden ayudar a agilizar las decisiones terapéuticas tempranas y mejorar los resultados en pacientes de alto riesgo. Sin embargo, el uso indiscriminado de estos agentes de amplio espectro puede acelerar el desarrollo de resistencia, en paralelo con la crisis de resistencia a los antimicrobianos observada con los carbapenémicos en las infecciones bacterianas. La aparición de C. auris multirresistentes y panresistentes ya indica este riesgo, lo que subraya la necesidad de un uso prudente basado en la claridad diagnóstica y los principios de administración responsable.
La carga económica del tratamiento tardío o inadecuado de la CI va mucho más allá del coste de adquisición de los antifúngicos. En pacientes críticos, una terapia ineficaz suele provocar estancias prolongadas en la UCI, infecciones secundarias, aumento de la necesidad de soporte orgánico y mayor mortalidad, todo lo cual ejerce una presión considerable sobre sistemas de salud que ya de por sí requieren muchos recursos. En este contexto, los costes posteriores de una mala gestión pueden eclipsar el precio del propio antifúngico. Sin embargo, los ensayos clínicos actuales rara vez se diseñan para abarcar estos aspectos más amplios. La mayoría de los estudios fundamentales emplean diseños de no inferioridad, comparando nuevos fármacos con terapias establecidas en poblaciones estrechamente definidas, sin evaluar criterios de valoración reales como el alta precoz de la UCI, la reducción de los costes hospitalarios, la prevención de infecciones secundarias o la mitigación de la resistencia. Por lo tanto, el valor real debe definirse a través de estudios de fase IV, datos del mundo real y vigilancia posterior a la comercialización, en particular en poblaciones subrepresentadas, como los enfermos críticos, los que reciben apoyo extracorpóreo o los pacientes en entornos con recursos limitados.
Conclusión
La CI en la UCI exige una acción rápida y estructurada: reconocer el riesgo de forma temprana, agrupar los diagnósticos rápidos y aplicar la administración responsable en cada etapa. Utilice la BDG por su alto valor predictivo negativo para suspender o suspender los antifúngicos empíricos dentro de un plan de suspensión predefinido y evitar el cribado indiscriminado con BDG. Cambie de una terapia empírica generalizada a una iniciación estratificada por riesgo y basada en biomarcadores; acorte los tratamientos una vez que se logre el control de la fuente; y reserve los agentes de acción prolongada con un espectro más amplio para la resistencia, una mejor penetración o las necesidades de adherencia. Optimice la exposición con dosificación guiada por FC/FD y TDM rutinaria de azoles. Estas medidas ofrecen medicina práctica y de precisión en forma de CI, a la vez que crean espacio para evaluar y adoptar nuevos agentes a medida que la evidencia madure.


