La sepsis se define como una disfunción inmunitaria y una insuficiencia orgánica múltiple derivadas de respuestas desreguladas a una infección aguda inicial, que posteriormente permiten que el patógeno instigador se vuelva sistémico. Este trastorno afecta a un promedio de 1,7 millones de personas en los Estados Unidos anualmente y provoca 300.000 muertes cada año. A nivel mundial, ∼50 millones de personas experimentan un evento séptico cada año, de las cuales ∼11 millones morirán. Además, la sepsis sigue siendo la hospitalización más costosa por paciente, con costos hospitalarios agregados de 3.800 millones de dólares y más de 2.000 estancias hospitalarias al año. Las infecciones respiratorias, intestinales y genitourinarias son responsables de la mayoría de los casos de sepsis. La incidencia de sepsis aumenta en aquellos con comorbilidades, como diabetes, enfermedad pulmonar obstructiva crónica y cáncer. La sepsis se diagnostica clínicamente cuando un paciente alcanza puntuaciones específicas de la Evaluación de Falla Orgánica Secuencial basadas en respuestas fisiológicas como la presión arterial, la frecuencia respiratoria y los cambios en la conciencia mental. Sin embargo, también se presentan otros componentes de la sepsis, como cambios celulares y metabólicos.
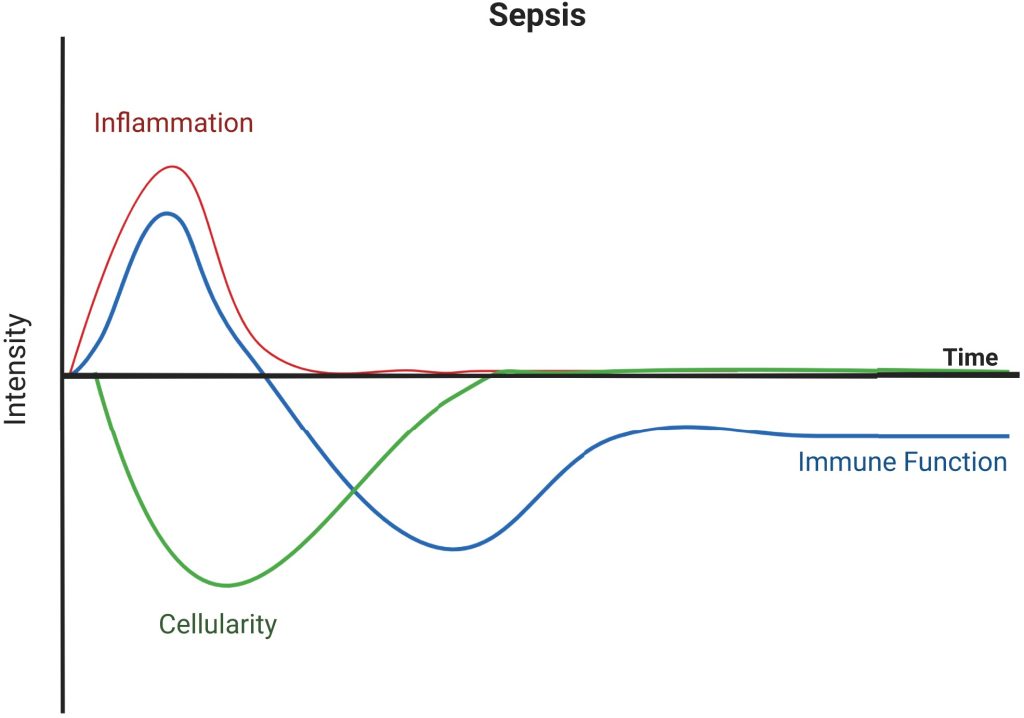
Existen tres características inmunológicas canónicas de la sepsis (Fig. 1). La primera es la tormenta de citocinas, que es una respuesta hiperinflamatoria a la infección diseminada. Durante esta fase, se liberan sistémicamente citocinas proinflamatorias y antiinflamatorias, como TNF-α, IL-6 e IL-10. En medio de la tormenta de citocinas, se desarrolla una linfopenia profunda, que es la segunda característica inmunológica de la sepsis. Los linfocitos de la circulación y los órganos linfoides secundarios experimentan apoptosis, lo que provoca que los pacientes sépticos experimenten una reducción significativa del recuento absoluto de linfocitos, así como del número de linfocitos T CD4+, linfocitos T CD8+, linfocitos B y linfocitos NK. Se cree que la linfopenia ayuda a contrarrestar la tormenta de citocinas, pero su grado varía entre huéspedes, de modo que puede predecir y contribuir a un pronóstico desfavorable tras el evento séptico. Finalmente, existe una fase prolongada marcada por la supresión inmunitaria denominada inmunoparálisis, que sigue a los pacientes mucho después de su estancia hospitalaria. Las células inmunitarias que se mantuvieron durante la linfopenia y las que se recuperaron mediante la proliferación homeostática poslinfopénica se someten a una reprogramación que las vuelve hiporreactivas a la estimulación posterior. Clínicamente, esta fase de la sepsis se define como el síndrome de inflamación persistente, inmunosupresión y catabolismo. Se sugiere que el síndrome de inflamación persistente, inmunosupresión y catabolismo contribuye a la enfermedad crítica crónica observada en pacientes que se recuperan de la sepsis, en la que presentan una mayor susceptibilidad a las infecciones secundarias debido a su estado de inmunosupresión. Los sueros de estos pacientes con enfermedad crítica crónica indican concentraciones elevadas de marcadores inmunosupresores, como PD-L1 soluble e IL-10, y marcadores del metabolismo del estrés, como PCR y GLP-1. Al mismo tiempo, estos pacientes presentan cantidades reducidas de factores de crecimiento hematopoyético, como GM-CSF. Además, los linfocitos T de pacientes con sepsis tienen menor capacidad para producir IFN-γ en respuesta a la señalización del TCR, así como IL-6, TNF-α e IL-1β tras la estimulación con LPS, en comparación con los controles sanos. Por consiguiente, los pacientes con sepsis presentan peores pronósticos (en comparación con los pacientes críticos sin sepsis) un año después del alta.
Se han desarrollado modelos murinos para estudiar las complejidades de la sepsis y su impacto en el sistema inmunitario de maneras que no son posibles con muestras humanas. Uno de estos modelos implica la administración de LPS purificado para inducir inflamación sistémica mediante la estimulación de TLR4. Este modelo favorece la activación del sistema inmunitario innato, pero la respuesta inflamatoria al LPS es de corta duración, se restringe a la estimulación de un solo TLR y no funciona en todos los modelos murinos, como en huéspedes con señalización defectuosa de TLR4. Además, los ratones son significativamente menos sensibles al LPS que los humanos, lo que lleva a algunos investigadores a cuestionar la relevancia de este modelo para la sepsis humana. En contraste con la inflamación estéril inducida por LPS, otros modelos de sepsis inyectan patógenos microbianos viables sistémicamente o i.p. en huéspedes murinos, lo que proporciona un repertorio más amplio de patrones moleculares asociados a patógenos para la estimulación inmunológica. Sin embargo, la salvedad de este modelo es que, a diferencia de los huéspedes humanos, i.p. Las inyecciones no suelen reflejar los focos naturales de infección primaria, como el sistema pulmonar o urinario, y la sepsis intraabdominal humana suele ser de naturaleza polimicrobiana. Se desarrolló un tercer modelo de sepsis preclínica considerando los resultados inmunológicos y fisiológicos de la sepsis: la ligadura y punción cecal (LPC). El resultado de la LPC es una sepsis polimicrobiana que produce muchos de los mismos indicadores inmunológicos (p. ej., tormenta de citocinas, linfopenia e inmunoparálisis) y fisiológicos (p. ej., aumento de las concentraciones sanguíneas de creatinfosfoquinasa y nitrógeno ureico en sangre) de la sepsis humana. La gravedad del evento séptico en el modelo LPC puede modularse en función de la longitud del ciego ligado, el calibre de la aguja utilizada para puncionarlo, el número de punciones realizadas en el ciego y la cantidad de materia fecal extruida y liberada en el peritoneo. La LPC es actualmente el modelo murino más utilizado para estudiar la sepsis aguda y la inmunoparálisis crónica. Esta revisión destacará el conocimiento actual que define los cambios numéricos y la reprogramación funcional que experimentan diversas células inmunitarias durante la sepsis y que contribuyen al estado de inmunoparálisis, centrándose en las células dendríticas (CD), los linfocitos T, los linfocitos B y las células NK. Es importante tener en cuenta que actualmente no existen datos clínicos que caractericen el estado de inmunoparálisis inducido por sepsis a nivel mecanístico, ni es posible identificar qué pacientes con sepsis desarrollarán esta afección ni su duración. Por lo tanto, nuestra discusión abarcará datos procedentes de estudios preclínicos en ratones y estudios clínicos que definen algunos de los parámetros inmunológicos que, en conjunto, resultan en el estado de inmunoparálisis observado en los supervivientes de sepsis. Indicaremos claramente la fuente de los datos para minimizar cualquier confusión. También reconocemos que existen ciertas preocupaciones al intentar equiparar el impacto de la sepsis en el sistema inmunitario murino con la disfunción inmunitaria humana observada durante la sepsis. Por consiguiente, hemos incluido una discusión de datos preclínicos que describe el papel de la experiencia inmunitaria previa en la hiperinflamación aguda inducida por sepsis y la posterior disfunción inmunitaria. Este tema se abordará en el contexto de dos modelos murinos: uno con huéspedes expuestos a microbios comensales y patógenos naturales, y el otro con huéspedes infectados secuencialmente con varios patógenos experimentales bien establecidos. Pasaremos al concepto de comorbilidades asociadas con la sepsis, ilustrando cómo contribuyen a la gravedad de eventos sépticos posteriores con los ejemplos de autoinmunidad y cáncer. Finalmente, volveremos al tema de la inmunoparálisis séptica, cambiando el contexto al definir sus impactos en la autoinmunidad posterior y el desarrollo de cáncer. En general, el objetivo de esta revisión es proporcionar información y contexto de la inmunoparálisis séptica proveniente de la evaluación de modelos murinos y muestras de pacientes, con consideraciones de cómo el trasfondo inmunológico del huésped impacta el evento séptico.
Alteraciones celulares durante la sepsis
Células dendríticas
Las células dendríticas (CD) adquieren, procesan y presentan Ag a las células T CD4+ y CD8+ que responden. En consecuencia, cualquier alteración en el número y la función normales de las CD puede tener un impacto significativo en la preparación de las células T. Los pacientes pediátricos con sepsis presentan una frecuencia reducida de subgrupos de CD como resultado del aumento de la apoptosis y la tendencia a la disminución de la expresión de marcadores coestimuladores y HLA-DR (24). Lo mismo se observa en pacientes humanos adultos, con descensos numéricos tempranos en las CD mieloides circulantes y las CD plasmocitoides, que se mantienen en pacientes con infecciones secundarias posteriores adquiridas en la unidad de cuidados intensivos (UCI).
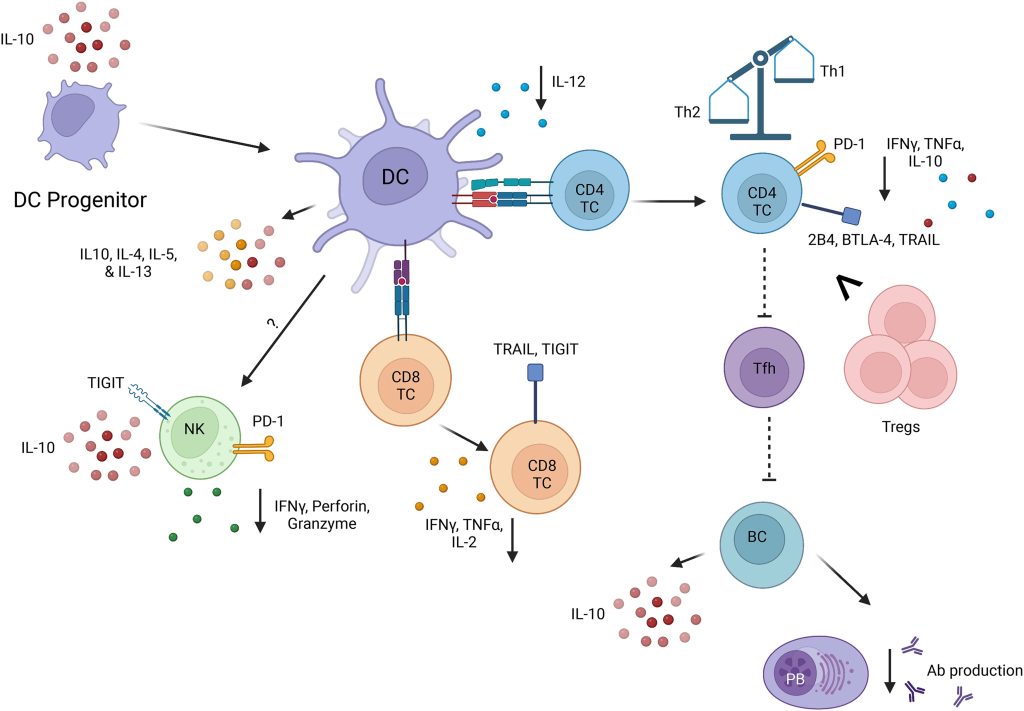
Trabajos previos de nuestro grupo y otros han revelado déficits numéricos y funcionales de múltiples subgrupos de CD en el bazo y los ganglios linfáticos periféricos de ratones tras sepsis mediada por LPH (Fig. 2). El conjunto restante de CD presentó una composición alterada y una menor capacidad para producir citocinas importantes para la inmunidad celular (p. ej., IL-12) en respuesta a patógenos secundarios. Curiosamente, esta incapacidad de las células dendríticas (CD) para producir IL-12 (y el aumento concomitante de la producción de citocinas Th2 como IL-4, IL-5 e IL-13) resulta de cambios epigenéticos inducidos por la sepsis en las CD, mediados por el reclutamiento diferencial de complejos de histona metiltransferasa a las regiones promotoras de IL-12. Dado que las CD ofrecen protección temprana contra la inflamación sistémica excesiva en un modelo murino de endotoxemia por LPS mediante la inhibición de la producción de IL-12 mediada por el receptor de glucocorticoides, esto podría sugerir un posible mecanismo para la disminución de IL-12 en la etapa de inmunoparálisis. Los progenitores de CD en la médula ósea de ratones también se agotan durante la sepsis, lo que produce células hijas que adquieren funciones más similares a las reguladoras (es decir, la producción de IL-10). Las CD derivadas de la médula ósea (CDMO) contribuyen a los déficits funcionales en la sepsis no solo al aumentar su propia producción de IL-10, sino también al disminuir las respuestas totales y específicas de las células NK contra la infección bacteriana secundaria posterior. La composición y función de las células progenitoras de células dendríticas (CD) murinas se ve afectada por las células T CD8+ en la médula ósea de forma dependiente de TLR2. Estas células T CD8+ influyen en la capacidad de las CD para producir IL-12 y suprimir la producción de IL-10 y TNF-α cuando maduran. Estos datos indican alteraciones numéricas y en la producción de citocinas en las CD. Se requiere más investigación para determinar los mecanismos que contribuyen a estas disminuciones de la función, así como la presentación de Ag, con el fin de fundamentar futuras terapias.
Células T CD8
El compartimento de células T CD8 experimenta cambios cuantitativos y cualitativos durante las fases de linfopenia e inmunoparálisis de la sepsis. En ratones, las células T CD8 vírgenes observan una reducción numérica transitoria en la sangre y los órganos linfoides secundarios durante la sepsis. Cuando se recuperan, estas células T presentan fenotipos activados por el aumento de la expresión de CD44 y CD11a a pesar de ser vírgenes o inexpertas a su Ag cognado. La adquisición del fenotipo activado podría ser causada por la generación de células T de «memoria virtual» (Tvms), una población de células vírgenes que expresan proteínas que se encuentran típicamente en las células T experimentadas con Ag a pesar de la ausencia de reconocimiento de Ag cognado después de expandirse a través de la proliferación homeostática. La producción posterior de citocinas y las respuestas específicas de Ag de estas células T CD8 vírgenes de ratón son bajas cuando se estimulan para convertirse en células efectoras. Además, aunque los Tvms en ratones más jóvenes pueden resultar beneficiosos para la inmunidad y la protección, los Tvms CD8 se vuelven senescentes y proliferan deficientemente en huéspedes de mayor edad, lo que podría contribuir a respuestas deficientes posteriores a la sepsis en la población séptica de edad avanzada. Estudios futuros podrían tender en esta dirección evaluando no solo la presencia de estos Tvms, sino también su relevancia e impacto, especialmente en poblaciones de ratones y humanos de edad avanzada. La expansión de células T CD8 vírgenes en el huésped murino séptico puede verse aún más obstaculizada por células dendríticas (CD) con respuesta deficiente. Las células T CD8 de memoria en la sangre y los órganos linfoides secundarios de ratones también experimentan reducciones numéricas transitorias durante la sepsis. No debería sorprender que la gravedad de la sepsis determine la magnitud de la linfopenia de células T circulantes, con una mayor pérdida celular durante la sepsis más grave. Curiosamente, la pérdida de células T CD8 de memoria residentes en el tejido murino y la permeabilidad endotelial, por el contrario, solo se ven afectadas en casos de sepsis grave. Recientemente publicamos una revisión que detalla la gran cantidad de alteraciones agudas y a largo plazo que afectan a las células T CD8 de memoria de ratones y humanos, y remitimos a los lectores a esa publicación para obtener información más detallada.
Células T CD4
Un sello distintivo de las células T CD4 es su capacidad de diferenciarse en subconjuntos con funciones efectoras únicas capaces de sesgar las respuestas inmunitarias tras la exposición a citocinas polarizadoras en el contexto de la presentación de Ag cognados. De forma similar a las células T CD8, las células T CD4 de ratón y humanas experimentan una linfopenia profunda desde el inicio de la sepsis, seguida de cambios cualitativos una vez que se ha recuperado predominantemente el número de células. Los primeros estudios en humanos que examinaron la producción de citocinas de las células T CD4 de pacientes sépticos sugirieron un cambio de subconjunto de Th1 a Th2. Sin embargo, un estudio en humanos más reciente utilizando células recién aisladas del bazo y el pulmón encontró muy poca producción de citocinas (IFN-γ, TNF-α o IL-10) tras la estimulación con mAb anti-CD3/CD28, lo que sugiere que las células T CD4 postsépticas experimentan un estado global de anergia. Además, las células T CD4 postsépticas han aumentado la expresión de los receptores inhibidores, incluidos PD-1, 2B4, BTLA-4 y TRAIL, probablemente impulsado por la exposición prolongada a citocinas proinflamatorias y antiinflamatorias. Otro cambio definido en los subconjuntos de células T CD4 humanas después de la sepsis es una sobrerrepresentación de células T reguladoras (Tregs) en la circulación. Se ha demostrado que este aumento en la frecuencia de Tregs es el resultado de la pérdida preferencial de otros subconjuntos de células T CD4 (p. ej., Th1, Th2, Th17). IL-33, un mediador de tipo 2 liberado como resultado del daño tisular, también contribuye a la presencia de estos Tregs en ratones tanto directa como indirectamente. Debido a que no se ha observado una mayor proliferación de Tregs durante la sepsis, se ha sugerido que los Tregs humanos podrían ser más resistentes a la apoptosis inducida por sepsis que otros subconjuntos de células T CD4. Las células T CD4 murinas postsépticas tienen una capacidad disminuida para proporcionar ayuda a otras células inmunitarias, como en el caso de la ayuda de las células T CD4 auxiliares foliculares a las células B, lo que limita la capacidad del huésped para responder eficazmente a nuevas infecciones. En la fase de inmunoparálisis, los pacientes sépticos recuperados presentan tasas más altas de reacción al CMV y al VHS, infecciones que dependen de la inmunidad eficaz de las células T CD4 para limitar su frecuencia y gravedad en humanos. Sin embargo, los mecanismos por los cuales la inmunoparálisis altera el control de la infección latente aún no se han definido con claridad, lo que ofrece nuevas vías de investigación que pueden facilitar el manejo del paciente tras la sepsis.
Células B
Los linfocitos B son el principal tipo de célula inmunitaria dentro del sistema inmunitario humoral adaptativo y son responsables de la producción de anticuerpos. Al igual que los linfocitos T, los linfocitos B experimentan una disminución drástica en su número durante la fase de linfopenia transitoria de la sepsis. Un estudio de Shankar et al. demostró que la linfopenia inducida por sepsis en humanos se asociaba con recuentos absolutos de linfocitos B significativamente más bajos y una disminución selectiva de los linfocitos B de memoria. Esta disminución de los linfocitos B de memoria contribuye al estado inmunitario suprimido que experimentan los pacientes sépticos. Los linfocitos B presentes durante la fase de inmunoparálisis de la sepsis, incluyendo tanto los linfocitos B que evitan la apoptosis aguda como los linfocitos B recién reabastecidos, parecen estar más agotados con una producción reducida de anticuerpos. Al mismo tiempo, la capacidad funcional de los linfocitos B humanos para producir IL-10 se mantiene, con una producción ex vivo mayor en pacientes sépticos en comparación con sujetos de control sanos. Esto puede alterar la capacidad de otras células inmunitarias para generar una respuesta eficaz a una infección posterior. A pesar del aumento del número de células plasmáticas, la producción de anticuerpos específicos de Ag en ratones se ve afectada después de la sepsis. Además, la sepsis produce una mayor representación de linfocitos B maduros y una reducción del porcentaje de linfocitos B inmaduros, tanto en ratones como en humanos. Las futuras líneas de investigación sobre las alteraciones de los linfocitos B y la inmunidad humoral durante la fase de inmunoparálisis de la sepsis podrían incluir epítopos específicos de patógenos en ratones y humanos, así como el impacto de la sepsis en las vacunaciones previas y posteriores.
Células NK
Las células NK son una población de linfocitos independiente del TCR, poco estudiada en el contexto de la sepsis. Estas células proporcionan una protección independiente de Ag contra patógenos, ya sea secretando citocinas o lisando células diana mediante citotoxicidad celular dependiente de Ab. Al igual que en las poblaciones celulares descritas anteriormente, las células NK se reducen en número y la función de las citocinas poco después de un evento séptico. Al igual que en las poblaciones descritas previamente, las células NK sufren una drástica disminución numérica y funcional en la sangre de pacientes sépticos, especialmente en pacientes fallecidos, en quienes la reducción del número de células y la producción de granzima B y perforina se ven exacerbadas.
En modelos murinos, la expresión reducida de DAP12 y la señalización deficiente de LY49H/D contribuyen a estas respuestas alteradas de las células NK. Esto, a su vez, reduce la capacidad de las células NK para eliminar virus, como el citomegalovirus murino. Las células NK murinas se vuelven menos sensibles a la estimulación con agonistas de TLR después de un evento séptico. Un posible mecanismo contribuyente reside en las BMDC supresoras analizadas previamente. Las BMDC de ratones sépticos cultivados con células NK vírgenes redujeron la capacidad de estas células para secretar IFN-γ al ser estimuladas con Pseudomonas aeruginosa como modelo in vitro de infección secundaria. Estos datos preclínicos se corroboran con estudios en humanos en los que se observó una frecuencia reducida de células NK de pacientes sépticos que expresaron CD107 e IFN-γ durante experimentos de cultivo ex vivo de citotoxicidad celular natural y dependiente de Ab. Las células NK murinas también aumentan la expresión del receptor coinhibitorio TIGIT durante la sepsis. Dado que la eliminación global de TIGIT ha mejorado los resultados de la sepsis, esto podría sugerir una contribución de las células NK a la respuesta apoptótica durante la sepsis. Cuando se analizó PD-1 en pacientes sépticos, aquellos pacientes con >5 % de células NK PD-1+ en sangre presentaron un mayor riesgo de presentar malos resultados. La expresión de PD-1 en células NK humanas se correlacionó con la mortalidad a los 28 días. Independientemente de su función proinflamatoria inhibida en esta etapa, las células NK aún pueden contribuir a resultados protectores en huéspedes sépticos.
Los pacientes sépticos presentan una mayor expresión de IL-10 en comparación con los controles sanos 24 h después del ingreso. La disminución de células NK en ratones conduce a un aumento de la inflamación y la mortalidad durante el LPH, debido en parte a la producción específica de IL-10 antiinflamatoria por parte de las células NK, lo que afecta estos resultados en este modelo. Sin embargo, la IL-10 también puede ser producida por macrófagos CD169+ y M2, y la eliminación selectiva de la producción de IL-10 de los macrófagos CD169+ resultó en un aumento de la inflamación y la muerte poco después de la inyección de LPS. Si bien ambos estudios atribuyeron un papel crítico a la IL-10 producida por células NK o macrófagos residentes en los tejidos en el LPH o la sepsis inducida por LPS, respectivamente, se necesitan estudios adicionales para definir el papel preciso de la IL-10 en el desarrollo de un estado de inmunoparálisis inducido por sepsis de larga duración. Este también puede ser un ejemplo que resalta la necesidad de desarrollar (y mejorar) modelos experimentales para la investigación sobre la sepsis, ya que permite estudios mecanísticos bien controlados que podrían fundamentar y enfocar estudios más complejos en humanos. En conjunto, estas publicaciones resaltan alteraciones marcadas en múltiples poblaciones de células inmunitarias causadas por la sepsis, lo que justifica un mayor estudio de su papel en la sepsis, especialmente con contribuciones tan contradictorias en términos de protección y agotamiento.
Impacto del estado inmunitario basal en la supresión inmunitaria de la sepsis
Aunque la sepsis puede desregular el sistema inmunitario, como se explicó anteriormente, casi toda la investigación preclínica de la inmunoparálisis inducida por sepsis se ha realizado con ratones ingenuos alojados en un sistema libre de patógenos específicos (SPF). Es innegable que el uso de ratones SPF en estos experimentos ha generado un amplio conocimiento sobre los complejos cambios que ocurren en el sistema inmunitario tras un evento séptico. Sin embargo, existen diferencias importantes entre los ratones SPF utilizados en la mayoría de las investigaciones preclínicas sobre sepsis y los humanos, lo que ha llevado a algunos investigadores a cuestionar la relevancia general de la investigación exhaustiva sobre sepsis en ratones. El alojamiento en SPF ha aumentado la reproducibilidad experimental, pero el sistema inmunitario de los ratones SPF está dominado por células con un fenotipo ingenuo debido a la exposición intencionalmente limitada a microbios naturales. En contraste, los humanos experimentan encuentros diarios con una gran cantidad de microbios comensales y patógenos, que, junto con las diversas vacunas recibidas a lo largo del tiempo, entrenan y moldean el sistema inmunitario humano adulto para que esté compuesto principalmente por células con fenotipo de memoria. En los últimos 10 años, los investigadores han reconocido la discordancia entre los sistemas inmunitarios de ratones de laboratorio y humanos adultos. En consecuencia, se han desarrollado varios modelos murinos que generan huéspedes con experiencia microbiana y sistemas inmunitarios maduros para simular los sistemas inmunitarios más preparados, con experiencia en Ag, que se observan en humanos. Uno de estos modelos de ratones «sucios» consiste en coalojarlos en ratones de laboratorio SPF con ratones de tiendas de mascotas. Estos ratones son portadores de una variedad de microbios (muchos de ellos virus) que suelen ser excluidos por el alojamiento SPF, y la exposición de los ratones SPF a estos microbios modifica drásticamente el sistema inmunitario, favoreciendo la proliferación de linfocitos T y B de memoria. De forma similar a este modelo, algunos investigadores han utilizado ratones salvajes o ratones mantenidos en recintos al aire libre para permitir la exposición a agentes ambientales que promueven la maduración del sistema inmunitario. Otro modelo de ratón con experiencia microbiana se basa en la infección secuencial de huéspedes murinos endogámicos con patógenos de laboratorio estándar adaptados a ratones, como la influenza A y Listeria monocytogenes, a los que nos referiremos como huéspedes con experiencia en patógenos específicos (SPexp). Aunque los investigadores varían los patógenos utilizados, la secuencia de las diferentes infecciones y el tiempo entre infecciones en sus modelos SPexp, todas las versiones generan grandes grupos de células T con Ag y niveles basales más altos de citocinas circulantes.
La exposición previa a patógenos, ya sea mediante el modelo de coalojamiento o el modelo de infección secuencial, genera peores resultados en ratones sépticos. La expresión basal de TLR aumenta en las células mieloides obtenidas de ratones coalojados en comparación con los ratones SPF alojados tradicionalmente, lo que ayuda a explicar por qué los ratones coalojados son más sensibles a la estimulación de TLR4, lo que resulta en un mayor número de muertes utilizando los modelos de sepsis de endotoxemia por LPS y CLP. Curiosamente, aunque las células NK proporcionan cierta protección contra la mortalidad por sepsis inducida por LLP mediante la producción de IL-10 dependiente de IL-15, el papel protector de las células NK observado en ratones SPF se altera en ratones SPexp. La depleción de células NK mejoró la supervivencia de los ratones SPexp sépticos en comparación con los ratones SPexp de control tratados con Ab, lo que sugiere un papel inflamatorio de las células NK en huéspedes con experiencia. Los correceptores inhibitorios también se ven afectados en huéspedes murinos inmunológicamente experimentados, ya que TIGIT contribuye a un fenotipo protector en huéspedes sépticos SPexp, contradiciendo su función definida en estudios previos. Dadas estas diferencias en las poblaciones celulares previamente investigadas en sepsis, pero esta vez en un modelo inmunológicamente más similar a un humano con experiencia en múltiples patógenos, es necesario volver a evaluar las nociones de inmunoparálisis previamente establecidas, considerando estos modelos.
La sepsis puede verse exacerbada por comorbilidades
La sepsis se caracteriza comúnmente en la población de edad avanzada, quienes al ingresar a la clínica o a la UCI con frecuencia presentan comorbilidades junto con su sepsis. Ejemplos de enfermedades comórbidas en pacientes sépticos incluyen hipertensión, diabetes, cáncer y enfermedades orgánicas crónicas. Algunas comorbilidades, como la obesidad, ofrecen resultados más protectores al inicio de la sepsis, aunque podrían resultar perjudiciales a largo plazo para la disfunción orgánica, según datos preclínicos y clínicos. El impacto de la diabetes en los resultados de los pacientes sépticos aún es objeto de debate, y la mayoría de los datos apuntan a la ausencia de diferencias en la supervivencia o la expresión de PD-1 en las células T a los 28 días posteriores al reclutamiento. Los modelos murinos han podido destacar cierto impacto de la diabetes en los resultados de la sepsis, como la alteración de la movilidad/función de los neutrófilos, la supervivencia del huésped, la inflamación del SNC mediada por la sepsis y la reducción de la respiración mitocondrial. Sin embargo, la combinación de algunas de estas enfermedades crónicas con una infección aguda puede aumentar la probabilidad de que la infección inicial progrese a sepsis. Una publicación de Sinapidis y colegas destaca no solo las interacciones de estos parámetros que conducen a la sepsis, sino también que dos o más comorbilidades aumentan la incidencia de sepsis y la mortalidad a los 28 días. En conjunto, estos datos ilustran la necesidad de profundizar en el estudio del impacto inmunológico de estas enfermedades crónicas en el huésped séptico. A continuación, describimos dos de estas comorbilidades, la autoinmunidad y el cáncer, que disminuyen la supervivencia en huéspedes sépticos.
Autoinmunidad y sepsis: un enfoque en la esclerosis múltiple
Las infecciones y la sepsis son diagnósticos comunes y causas de mortalidad hospitalaria en pacientes con enfermedades autoinmunes. En algunos casos, esto conduce a infecciones nosocomiales posteriores. La esclerosis múltiple es una enfermedad autoinmune neurodegenerativa debilitante que causa problemas sensoriales, visuales y de movilidad. Los pacientes con EM tienen mayor probabilidad de desarrollar sepsis que los pacientes sin EM y permanecen hospitalizados más tiempo después del ingreso en la UCI. Para modelar una evolución similar de la enfermedad acoplada, nuestro grupo ha utilizado un modelo experimental de encefalomielitis autoinmune (EAE) en combinación con sepsis inducida por LPH. Los ratones que experimentan EAE presentan perfiles inflamatorios circulatorios aumentados y tasas de supervivencia reducidas después de la inducción de sepsis en comparación con los ratones de control sin EAE. Esto ocurre independientemente de cuándo se produce el evento séptico después de la inducción de EAE o del modelo de sepsis utilizado. Mecanísticamente, los ratones con EAE con niveles más bajos de IL-10 en suero antes de la sepsis tuvieron peores resultados en términos de supervivencia, y aquellos que no sobrevivieron también presentaron niveles más altos de IL-6 12 h después del CLP en comparación con los ratones sin EAE y los sobrevivientes de EAE, lo que sugiere una tormenta de citocinas más severa. Aún quedan preguntas sobre qué células en los ratones con EAE producen los fenotipos inflamatorios que impulsan el aumento en la gravedad de la sepsis, así como posibles disminuciones o alteraciones mediadas por sepsis en la producción de autoanticuerpos específicos de EAE/EM, dadas las disminuciones mediadas por sepsis en Abs descritas anteriormente. Es importante destacar que la aplicación del modelo de sepsis preclínica a una iteración recurrente/remitente de EAE/EM representaría con mayor precisión la evolución de la EM observada en humanos. Otro ángulo a considerar es el vínculo entre el intestino, la sepsis y la autoinmunidad. La composición microbiana del intestino puede afectar los resultados tanto en la esclerosis múltiple como en la sepsis. En consecuencia, se ha demostrado que las especies bacterianas perjudiciales para la EAE son potencialmente beneficiosas para la LPH. Queda por definir cómo las alteraciones de la microbiota intestinal, que incluyen más especies bacterianas protectoras de la EM, afectan el resultado del evento séptico, o incluso la probabilidad de que una infección se vuelva sistémica.
Cáncer y sepsis
Otra comorbilidad a considerar al discutir la incidencia y los resultados de la sepsis es el cáncer. La sepsis ocurre en el 4% de los pacientes con cáncer, lo que lleva a una probabilidad de mortalidad del 35% hasta 1 año después del diagnóstico de cáncer. Los pacientes con cáncer y sepsis tienen más probabilidades de ser rehospitalizados dentro del mes posterior al alta y más probabilidades de enfrentar mortalidad intrahospitalaria en comparación con la sepsis no relacionada con el cáncer. Los datos murinos han demostrado que los huéspedes con tumores tienen peores resultados en la supervivencia séptica en comparación con los huéspedes sin tumores, a pesar de tener un tamaño y volumen tumoral menor. En un modelo de cáncer de páncreas murino, la inducción previa del cáncer resultó en una disminución de la supervivencia posepsia, especialmente ≥6 días después del evento séptico, que presumiblemente cae dentro de la fase de inmunoparálisis. Curiosamente, esta combinación (es decir, cáncer de páncreas y sepsis) produjo un aumento en los recuentos de células T esplénicas y una menor apoptosis de células T CD4. En cualquier caso, la activación de las células T CD8 se redujo y se observaron descensos de tendencia en las células B esplénicas y las células dendríticas. Aunque las células T CD8 específicas del tumor permanecen numéricamente sin cambios en el microambiente tumoral de huéspedes sépticos en comparación con los huéspedes tratados simuladamente, se observó una reducción en el número de células T CD8 específicas del tumor en la periferia de los ratones sépticos. Complementariamente a esto, hubo aumentos transcripcionales y proteicos de IL-10 en tumores B16 después de la sepsis, lo que sugiere que la sepsis tiene el potencial de expandir las respuestas supresoras. La eficacia terapéutica de los inhibidores de puntos de control también puede verse alterada por la sepsis. PD-1 se expresa a un nivel intermedio en linfocitos CD8 infiltrantes de tumores en un modelo de melanoma/CLP B16 de ratón en comparación con una alta expresión de PD-1 en las contrapartes simuladas. Estas diferencias entre el cáncer individual o los huéspedes sépticos en comparación con el modelo comórbido de cáncer antes de la sepsis sugieren la necesidad de tener en cuenta las diferencias en la eficacia de las terapias. De hecho, el trabajo de los grupos Coopersmith y Ford demostró que, si bien el bloqueo preclínico de PD-1 puede ser beneficioso solo para la sepsis, su impacto como terapia se invierte en el modelo comórbido de carcinoma de pulmón de Lewis/sepsis. En cambio, 2B4 demostró ser el mejor objetivo terapéutico en este caso al aumentar la supervivencia y reducir la expresión del receptor coinhibitorio. TIGIT, otro receptor coinhibitorio, está ligeramente aumentado en Tregs esplénicos y células NK de ratones LLC/sepsis en comparación con ratones solo con tumor. TIGIT contribuye a la reducción de la producción de citocinas de células T esplénicas, la expresión de células T CD4 de CTLA-4 y peores resultados para ratones sépticos con malignidad preexistente. Curiosamente, también hay datos preclínicos que muestran que la inducción de sepsis en un huésped con tumor puede promover una respuesta antitumoral efectiva, lo que lleva a un tamaño tumoral reducido para aquellos animales que sobreviven al evento séptico. En este contexto, la respuesta antitumoral inducida por sepsis incluyó una mayor generación de células con Ag específicas del tumor y la producción de IFN-γ por parte de linfocitos T CD8+ y células NK. La frecuencia de las células NK productoras de IFN-γ y granzima también aumentó tras la estimulación ex vivo con células tumorales en este modelo, lo que sugiere un potencial aumento de la inmunidad antitumoral por parte de las células NK tras la sepsis. Se sugiere también que la señalización de TLR4 durante la sepsis contribuye a esta disminución de la carga tumoral, ya que la ablación de la señalización de TLR4 en un modelo murino de sepsis con cáncer conduce a un aumento de tendencia en el volumen tumoral.
Impacto de la inmunoparálisis en trastornos inmunitarios posteriores
Cuando las desregulaciones celulares mencionadas anteriormente se aplican a desafíos inmunológicos posteriores, conducen a diferentes resultados para aquellos huéspedes que sobreviven a la agresión séptica. La sepsis reduce la gravedad de la inducción autoinmune posterior en el modelo murino de EM con EAE. Específicamente, nuestros grupos observaron que la sepsis provocó un déficit numérico e inflamatorio de células T CD4+ específicas del péptido de la mielina. Este cambio cuantitativo y cualitativo en las células T CD4+ específicas del péptido de la mielina redujo la puntuación de la enfermedad en ratones con EAE, proporcionando un fenotipo más protector. Sin embargo, esta consecuencia protectora de la sepsis fue temporal, ya que la capacidad de proliferación de las células T específicas de la mielina no se vio afectada. Por el contrario, la sepsis puede resultar perjudicial en un huésped que desarrolla cáncer después de su evento séptico. Las células tumorales B16 de ratones previamente sépticos expresan menores cantidades de MHC clase I en comparación con las células tumorales de ratones con tratamiento simulado, lo que probablemente conduce a una menor frecuencia de células T CD8+ dentro del tumor y a la producción de IFN-γ por parte de las células T CD8+. Esta función reducida de las citocinas no se limita al microambiente tumoral, ya que existe una disminución en las células T CD8 específicas de tumor productoras de IFN-γ y TNF-α en los ganglios linfáticos que drenan el tumor y el bazo. Además, la fase de inmunoparálisis crónica hace que estas células proliferen menos y experimenten mayores tasas de apoptosis, lo que impacta negativamente el ambiente tumoral al reducir la eficacia del bloqueo de puntos de control. La fase de inmunoparálisis somete críticamente a los huéspedes a estados inmunitarios alterados, predominantemente en sentido negativo. Se requieren más estudios para evaluar el impacto de la inmunoparálisis en otras infecciones estándar y oportunistas y trastornos inmunitarios. Los datos analizados en esta revisión sugieren que, si bien los sobrevivientes de la sepsis están preparados con respuestas antitumorales expandidas, la sepsis aún empeora los tumores posteriores, y las neoplasias malignas previas empeoran los resultados sépticos.
Conclusiones
Aunque las muertes en las primeras etapas de la sepsis han disminuido en las últimas décadas, los pacientes que sobreviven al episodio séptico inicial son propensos a sufrir infecciones secundarias. La inmunoparálisis, la reducción a largo plazo de la función linfocitaria, contribuye a esta susceptibilidad. Dado que los datos que podemos obtener de pacientes clínicos pueden ser limitados, muchos investigadores se basan en modelos murinos para descifrar mejor los impactos a largo plazo de la sepsis en el huésped. Las células dendríticas (CD) y los linfocitos tienen menor capacidad para generar respuestas protectoras contra moléculas patógenas innatas y específicas de Ag. El estado inmunológico del huésped al inicio de la sepsis puede tener un impacto significativo en la susceptibilidad a la sepsis y en la dinámica de las respectivas enfermedades/disfunciones inmunitarias. Las investigaciones preclínicas adicionales para estudiar los impactos del estado inmunitario del huésped antes de la infección que induce la sepsis, incluyendo la probabilidad de que una infección se vuelva séptica y la modulación terapéutica del sistema inmunitario de los pacientes sépticos para recuperar su funcionalidad, pueden mejorar aún más los resultados a largo plazo.
