Resumen
La doctrina Monro-Kellie, introducida a finales del siglo XVIII, fue un concepto innovador que buscaba explicar las interacciones entre los componentes del volumen intracraneal. Desde entonces, se ha convertido en una piedra angular de la fisiología cerebral, ahora conocida como dinámica intracraneal. Inicialmente, la doctrina se centraba en las observaciones fisiológicas de los tres componentes incompresibles de la bóveda craneal: tejido cerebral, sangre y líquido cefalorraquídeo (LCR). A lo largo de los siglos, los avances en neurociencia y tecnología médica han profundizado nuestra comprensión de la regulación de la presión intracraneal (PIC), sus implicaciones fisiopatológicas y su papel en los trastornos neurológicos. Esta revisión de la doctrina Monro-Kellie examina cómo interactúan las alteraciones de la autorregulación cerebrovascular, la compartimentación cerebral y el sistema glinfático en pacientes con lesión cerebral grave, lo que exige nuevas estrategias de manejo ante estas situaciones críticas. Además, refuerza la necesidad de un enfoque holístico de monitorización para mejorar el diagnóstico y la intervención temprana. La evolución de la evaluación de la PIC ha influido significativamente en el manejo del traumatismo craneoencefálico, la hemorragia espontánea, el ictus isquémico y la hidrocefalia. Con la introducción de herramientas innovadoras como la ecografía cerebral, la pupilometría automatizada y la monitorización no invasiva de la forma de onda de presión, el manejo de la PIC está evolucionando hacia estrategias de evaluación más accesibles y continuas. Esta revisión explora cómo la combinación de principios históricos con innovaciones de vanguardia está transformando la neuromonitorización y mejorando los resultados de los pacientes en cuidados críticos.
Una doctrina en constante evolución
La Doctrina Monro-Kellie (MK), formulada hace más de 240 años, sigue siendo un marco fundamental para comprender la regulación de la presión intracraneal (PIC). Describe el cerebro, la sangre y el líquido cefalorraquídeo (LCR) como componentes confinados dentro del compartimento de volumen fijo del cráneo. Esta doctrina se forjó gracias a las contribuciones científicas de Alexander Monro, George Kellie, George Burrows y Harvey Cushing, cuyo trabajo pionero sentó las bases para el manejo moderno de la PIC. Desde las observaciones anatómicas de Monro hasta los avances clínicos de Cushing, cada uno desempeñó un papel crucial en el perfeccionamiento de este concepto, ahora conocido como MK 1.0: «Cualquier aumento en el volumen de un componente debe compensarse con una reducción proporcional en otro para mantener la PIC estable».
Con el tiempo, los avances en la fisiología cerebral han impulsado revisiones significativas de la Doctrina Monro-Kellie original. Cada vez es más evidente que la interacción entre los componentes intracraneales es dinámica, no estática. En particular, la dinámica venosa desempeña un papel crucial en la regulación de la PIC. A diferencia del flujo sanguíneo arterial, que se rige principalmente por la circulación sistémica, el drenaje venoso cerebral se ve influenciado por factores externos, como el aumento de la presión intraabdominal o intratorácica y la compresión mecánica de las venas yugulares. Estos factores pueden causar congestión venosa, elevando la PIC incluso en ausencia de lesiones expansivas o procesos patológicos evidentes. Esta constatación condujo al perfeccionamiento de la doctrina en MK 2.0, que reconoce que la oclusión venosa o la alteración del flujo de salida pueden elevar la PIC independientemente de los cambios en la dinámica arterial o del LCR.
El concepto de MK 3.0 surgió de observaciones clínicas en afecciones como la hidrocefalia normotensiva (HNT) y la hipertensión intracraneal idiopática (HII). Estos casos revelaron que los cambios mecánicos en el tejido cerebral pueden causar cambios morfológicos cerebrales incluso en ausencia de lesiones expansivas o signos radiológicos de PIC elevada. Estos cambios morfológicos incluyen, en particular, la distensión de las fibras periventriculares en casos de HNT y la lesión del nervio óptico en casos de HII. Por otro lado, en la hidrocefalia comunicante de bajo grado, el cerebro puede experimentar adaptaciones estructurales en respuesta a las fugas de LCR, lo que conduce a la remodelación del cráneo y a la reducción del volumen cerebral debido a la pérdida de líquido intersticial (LI). Estas perspectivas evolutivas del concepto se resumen en la Tabla 1.
Monro-Kellie 1783-siglo XX |
El volumen total dentro del cráneo rígido (que comprende tejido cerebral, sangre y LCR) es constante, por lo que un aumento en un componente debe compensarse con una disminución en otro para mantener una PIC normal. |
Monro-Kellie 2.0 2016 |
La PIC ya no se considera aislada, sino parte de un sistema dinámico e interconectado, influenciado por las presiones extracraneales, en particular las de las cavidades torácica y abdominal. Estos compartimentos están anatómica y fisiológicamente vinculados a la bóveda craneal a través de vías venosas y cefalorraquídeas. |
Monro-Kellie 3.0 2019 |
Se observaron cambios en las propiedades elásticas del cerebro en pacientes con IIH y NPH, como remodelación de la forma del cerebro con un desplazamiento menor del cerebro en la bóveda craneal, pero desplazamiento del LCR. |
Monro-Kellie 4.0 |
Representa el cambio de paradigma del modelo tradicional de hipertensión intracraneal a uno centrado en la dinámica intracraneal deteriorada en lesiones cerebrales agudas, destacando la necesidad de un enfoque multimodal para garantizar una evaluación precisa. |
Tabla 1. Perspectivas evolutivas sobre la doctrina Monro-Kellie. LCR: líquido cefalorraquídeo, PIC: presión intracraneal, IIH: hipertensión intracraneal idiopática, NPH: hidrocefalia normotensiva
Doctrina Monro-Kellie 4.0
Desde una perspectiva clínica, MK 4.0 representa un cambio de paradigma en la comprensión y el manejo de la PIC en cuidados neurocríticos. Desafía la visión tradicional de que la elevación de la PIC se debe principalmente a lesiones de masa intracraneal, como se propuso en MK 1.0, y destaca el papel más amplio de la dinámica cerebrovascular (Fig. 1). El concepto central de MK 4.0 reconoce que en neuroemergencias como el traumatismo craneoencefálico (TCE), la hemorragia subaracnoidea (HSA) y el accidente cerebrovascular isquémico, por ejemplo, la autorregulación cerebrovascular (AC), el sistema glinfático (SG) y la reserva compensatoria cerebral son determinantes clave de la regulación de la PIC y la evolución del paciente. Por lo tanto, MK 4.0 subraya la importancia de las tecnologías de monitorización multimodal para el manejo del volumen y la presión arterial cerebrales. Reconoce que la falla de la autorregulación cerebrovascular (AC), incluso en ausencia de lesiones ocupantes de espacio, puede resultar en elevaciones críticas de la PIC. Este conocimiento es crucial para el manejo de afecciones que alteran los mecanismos naturales del cerebro para regular el flujo sanguíneo cerebral (FSC). La aplicación clínica de MK 4.0 amplía las estrategias de tratamiento más allá de la descompresión o el drenaje de LCR, incorporando la monitorización multimodal. Este enfoque permite un manejo personalizado para optimizar la perfusión cerebral dentro de los límites de autorregulación y la función del sistema glinfático, previniendo así lesiones cerebrales secundarias.
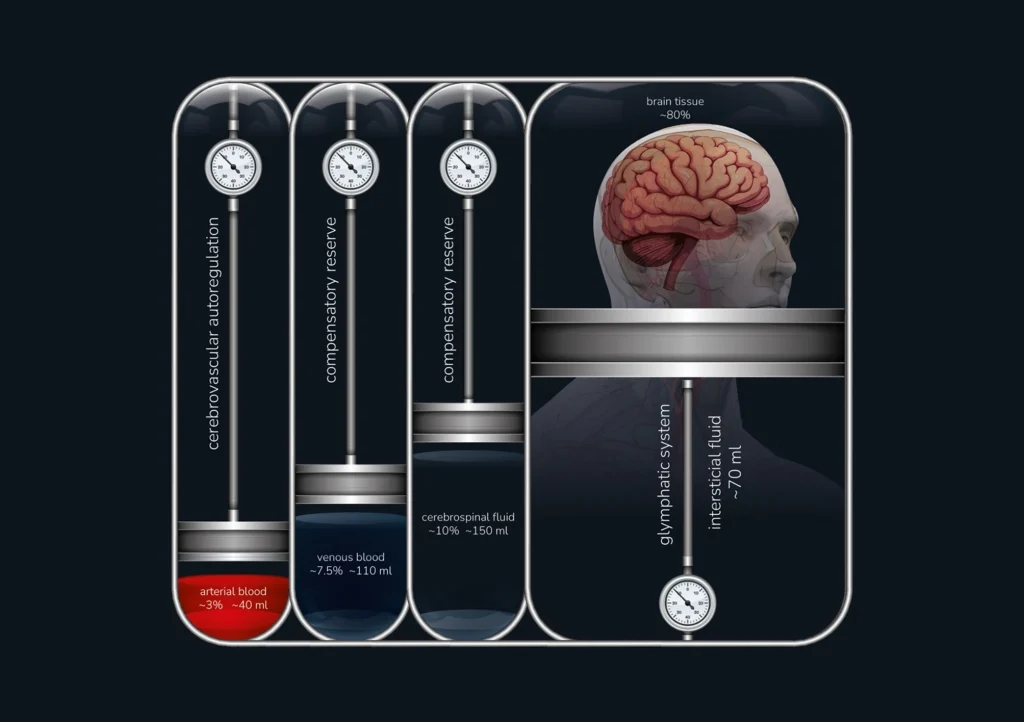
Papel de la autorregulación cerebrovascular en MK 4.0
A diferencia de otros órganos viscerales, el cerebro se aloja dentro de una estructura ósea rígida y está rodeado de LCR y sangre. Las variaciones dinámicas en sus volúmenes influyen directamente en la PIC. Como resultado, la perfusión cerebral en un cerebro sano no depende únicamente de la presión de eyección sanguínea (presión arterial o PA) en las arterias intracraneales, sino que está determinada por el gradiente entre la PA cerebral y la PIC. La monitorización de vanguardia de la presión de perfusión cerebral (PPC) implica la cuantificación precisa del volumen de sangre que llega a regiones específicas del tejido cerebral durante un intervalo de tiempo definido. Sin embargo, este enfoque se basa exclusivamente en estudios de perfusión con una resolución temporal limitada y no está disponible a pie de cama para pacientes críticos.
En consecuencia, una amplia investigación se ha centrado en la identificación de indicadores fiables para la estimación de la PPC en estudios tanto en humanos como en animales. Sin embargo, en la práctica clínica y la investigación sobre lesiones cerebrales agudas, la PPC a menudo se calcula simplemente restando la presión intracraneal (PIC) de la PA, que generalmente se mide en la arteria radial. Este método ignora posibles inexactitudes y puede llevar a conclusiones erróneas. De hecho, varios factores explican por qué la diferencia entre la presión arterial y la presión intracraneal (PAP) no refleja con precisión la presión arterial del paciente (PPC), como se explica a continuación:
Gradientes de presión arterial desde el corazón hasta el cerebro y dentro del cerebro
El cálculo de la presión arterial cerebelosa (PPC) varía considerablemente entre las instituciones sanitarias, incluso entre profesionales clínicos experimentados que atienden a pacientes con lesión cerebral. Esta variabilidad persiste independientemente de si el entorno se encuentra en países de ingresos altos o bajos o medios, debido principalmente a las diferencias en la monitorización de la presión arterial (PA). Es fundamental reconocer que los monitores multiparamétricos calculan automáticamente la PPC utilizando las entradas medias de la PA y la PIC. Sin embargo, la PA media en el corazón puede disminuir entre 10 y 15 mmHg al llegar a la base del cráneo. Ignorar este hecho puede llevar a los profesionales clínicos a sobreestimar la PPC real. Además, las arterias cerebrales forman una extensa red de ramificaciones a lo largo del tejido cerebral, lo que provoca una disminución progresiva de la presión arterial en las arterias más pequeñas más allá de la convexidad cerebral, alcanzando niveles potencialmente tan bajos como la mitad de la presión aórtica. Los pacientes neurocríticos presentan diversas afecciones fisiopatológicas que se distribuyen de forma desigual en el cerebro, influenciadas por las condiciones de salud preexistentes, la gravedad de la lesión y la progresión de la enfermedad. En consecuencia, confiar en la PPC derivada de mediciones globales intracraneales (PIC) y extracraneales (PAA) plantea un riesgo significativo de error en el manejo hemodinámico.
Disparidad entre las contrafuerzas PA y PIC
Las contribuciones de la presión arterial (PA) y la PIC a la presión arterial coronaria (PPC) no están equilibradas. Debido a las propiedades miogénicas, metabólicas y autonómicas de la CA, el flujo sanguíneo cerebral (FSC) puede adaptarse eficazmente a los cambios en la PA. Sin embargo, en pacientes neurocríticos, el deterioro de la CA varía y es directamente proporcional a la gravedad de la hipertensión intracraneal. Cabe destacar que estudios han demostrado que, en pacientes con lesiones cerebrales graves, incluso cuando la PIC se mantiene dentro de los rangos normales, una elevación leve controlada de aproximadamente 5 mmHg puede reducir la velocidad de la sangre cerebral. Esta reducción persiste más tiempo que la respuesta escalonada observada tras los cambios en la PA. La PIC elevada prolonga el tiempo de tránsito circulatorio y ejerce una influencia sostenida en la presión transmural vascular (producto área-resistencia), que permanece significativamente elevada incluso después de la reducción de la PIC mediante craneotomía descompresiva. Estos hallazgos indican que diferentes combinaciones de ABP y ICP pueden producir el mismo cálculo de CPP (p. ej., 75 − 15 = 85 − 25), lo que distorsiona la verdadera presión de perfusión dentro de la microcirculación cerebral (CPP ≠ ABP – ICP), como se ilustra en la figura 2.
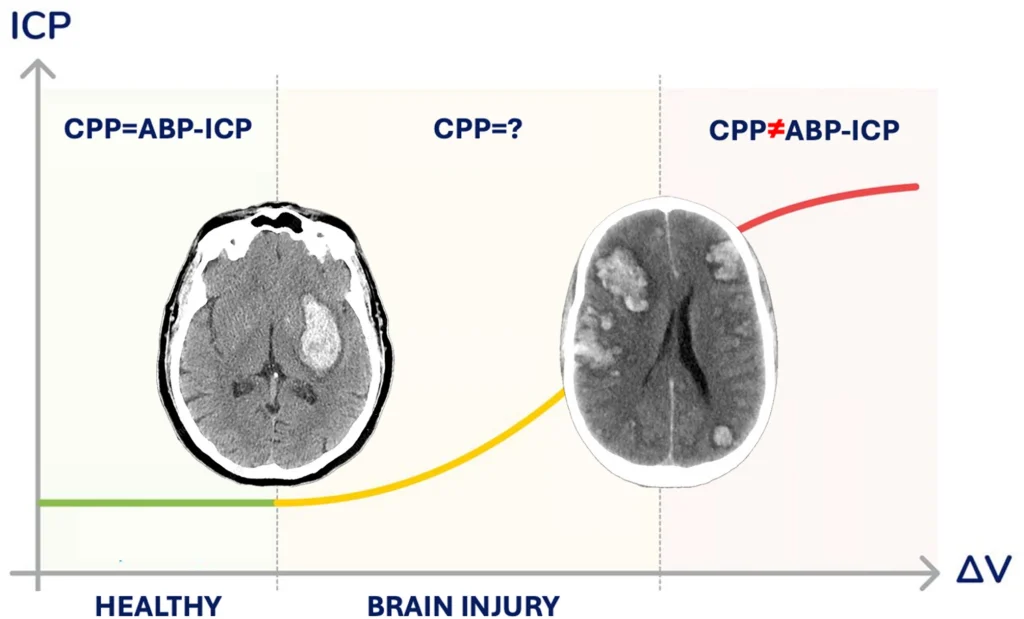
Presión crítica de cierre y límite inferior de CA
El límite inferior de la CA —el umbral por debajo del cual la perfusión cerebral se vuelve insuficiente para mantener la actividad neuronal— sigue siendo un tema de debate. Si bien se acepta comúnmente como 50 mmHg, una revisión de múltiples estudios sugiere que en realidad podría estar más cerca de los 70 mmHg. En pacientes con lesiones cerebrales graves, la CA se ve frecuentemente afectada, lo que reduce la capacidad del cerebro para compensar las fluctuaciones de la PAA y estrecha el rango de presión segura. Como resultado, los médicos pueden pasar por alto inadvertidamente el riesgo de hipoperfusión cerebral en pacientes normotensos, lo que podría llevar a una ausencia total de flujo sanguíneo cerebral, en particular durante la fase diastólica del ciclo cardíaco. Este fenómeno, donde el flujo sanguíneo cesa a pesar de una PAA positiva, se conoce como presión crítica de cierre (PCr). Las investigaciones han demostrado que la PCr fluctúa con las variaciones de la PIC, lo que significa que cuando hay hipertensión intracraneal, el umbral para el flujo sanguíneo cerebral cero aumenta.
Presión de perfusión cerebral
El propósito de estos argumentos es destacar la importancia de la monitorización personalizada en pacientes neurocríticos inconscientes. Sin un enfoque individualizado, puede producirse una perfusión cerebral insuficiente incluso cuando la presión arterial sistémica (PAA) se mantiene dentro de un rango aceptable. Varios estudios en pacientes críticos sugieren que la PPC puede ser un mejor predictor de resultados que la PIC por sí sola. Por lo tanto, uno de los principales objetivos en la atención neurocrítica es identificar la PPC individualizada óptima para guiar el manejo del paciente. Tanto una PPC excesivamente alta como una baja pueden ser perjudiciales, y el tiempo transcurrido fuera de los límites de autorregulación de un individuo puede afectar significativamente los resultados. El método más estudiado y actualmente el único para calcular continuamente la PPC óptima (CPPopt) se basa en un software específico (ICM+, Cambridge, Reino Unido). La CPPopt se determina identificando el rango de PAA que mejor se correlaciona con la estabilidad de la PIC, medido mediante el índice de presión-reactividad. Si bien la correlación entre PAA y PIC no es el indicador ideal para la perfusión cerebral, los estudios han demostrado que cuanto más tiempo permanecen los pacientes fuera del rango de CPPopt, mayor es la tasa de mortalidad. Desafortunadamente, este método requiere software específico y monitorización invasiva de la PIC, lo que limita significativamente su accesibilidad, especialmente en entornos con recursos limitados y salas de urgencias.
La próxima frontera para optimizar el manejo de la PPC reside en el desarrollo de métodos que permitan administrar la PPC ampliamente en entornos clínicos. Entre los enfoques no invasivos, el Doppler transcraneal (DTC) puede utilizarse para estimar la PPC, ofreciendo un alto valor predictivo positivo para detectar la PPC reducida, la afección que más preocupa a los médicos [46]. Sin embargo, el DTC solo proporciona mediciones intermitentes y requiere experiencia especializada, lo que limita su viabilidad. Un avance importante sería el desarrollo de una técnica fiable, no invasiva y en el punto de atención, capaz de guiar continuamente a los médicos en el mantenimiento de objetivos de perfusión cerebral personalizados.
Materialización de la dinámica intracraneal: el síndrome compartimental en MK 4.0
Dada la evolución de la doctrina MK, es necesario redefinir ciertas situaciones clínicas que tradicionalmente se han agrupado bajo el término «hipertensión intracraneal». Cada vez es más evidente que la PIC es más que un simple número. Un punto crítico de decisión terapéutica surge cuando la distensibilidad intracraneal y la oxigenación cerebral se ven comprometidas, incluso en pacientes con valores normales de PIC. Hasta ahora, incluso con los avances de MK 3.0, las guías clínicas, los consensos y los protocolos han recomendado intervenciones médicas o quirúrgicas exclusivamente en el TCE y cuando la PIC supera un umbral predefinido (normalmente 20-22 mmHg). En pacientes con ventilación mecánica, la intensificación del tratamiento se ha guiado tradicionalmente por una combinación de valores de PIC, examen pupilar y hallazgos de TC, a menudo sin considerar otros posibles biomarcadores.
Sin embargo, como se destaca en MK 4.0, algunos pacientes presentan distensibilidad intracraneal agotada e hipoxia cerebral a pesar de tener valores normales de PIC. Estos casos no pueden explicarse por factores fisiológicos sistémicos, identificados mediante parámetros de monitorización múltiple como el flujo sanguíneo cerebral (FSC), la hemodinámica sistémica y la oxigenación sistémica. El enfoque de la monitorización intracraneal se está desplazando de los valores absolutos de PIC hacia parámetros derivados de la PIC que han demostrado una correlación más fiable con la evolución del paciente. Estos incluyen: la relación P2/P1 y el tiempo hasta el pico, el índice de forma del pulso, el índice de PAD y la amplitud del pulso de la PIC.
El concepto de «Síndrome Compartimental Intracraneal (SCI)» se ha propuesto como un enfoque más preciso para la toma de decisiones en el manejo del TCE, aplicando todos los instrumentos disponibles para detectar lesiones cerebrales adicionales subyacentes. Este concepto integra la monitorización temprana de la compliancia intracraneal, invasiva o no invasiva, y las técnicas de oxigenación cerebral, invasivas o no invasivas, en entornos de urgencias, cirugía y UCI. El SCI permite la identificación temprana de pacientes de alto riesgo que requieren un tratamiento intensivo, independientemente de los valores de PIC. Si no se reconoce, este síndrome progresivo suele provocar una cascada de eventos de alta mortalidad, como hipertensión intracraneal grave, hipoxia tisular cerebral y hernia cerebral. Al reconocer el SCI como una entidad diferenciada, los médicos pueden implementar intervenciones más tempranas y específicas, lo que podría reducir la morbilidad y la mortalidad en pacientes con lesión cerebral aguda.
Antes de reconocer este concepto, tradicionalmente, los esfuerzos terapéuticos se intensificaban solo para pacientes que ya estaban en estado crítico o presentaban una alta carga de lesión cerebral. Este enfoque puede haber contribuido a la percepción sesgada de que el tratamiento es inútil para pacientes con lesión cerebral traumática de moderada a grave en todo el mundo. Las investigaciones futuras deben identificar los factores no tradicionales que contribuyen al agotamiento temprano de la distensibilidad intracraneal y cómo este deterioro puede conducir a hipoxia cerebral, incluso antes de la aparición completa del síndrome de hipertensión intracraneal tradicional.
La monitorización invasiva de la PIC sigue siendo fundamental en la atención neurocrítica; sin embargo, un modelo de PIC basado en un umbral estático no se integra en MK 4.0. En este contexto, los cambios en la morfología del pulso de la PIC representan un área crítica de enfoque. Las formas de onda de la PIC reflejan la relación entre la presión y la distensibilidad intracraneal, marcadores clave del deterioro neurológico temprano, como se destaca en Monro-Kellie 4.0. Si bien los monitores invasivos de la PIC pueden ayudar a los médicos a recopilar esta información, las interpretaciones actuales de la morfología de la onda de la PIC siguen siendo en gran medida subjetivas. Esto se debe a que los sistemas invasivos existentes no proporcionan métricas cuantitativas derivadas de la deformación de las formas del pulso de la PIC. Algunos fabricantes de monitores invasivos de la PIC han reconocido esta limitación y han anunciado planes para incluir dichos parámetros junto con los valores tradicionales de la PIC en un futuro próximo. Un descubrimiento revolucionario reveló que los movimientos craneales micrométricos tras cada latido pueden reproducir las ondas de la PIC, lo que permite el desarrollo de un método no invasivo para la monitorización de la distensibilidad intracraneal con múltiples aplicaciones clínicas. Esta innovación tiene el potencial de hacer que la monitorización de la PIC sea tan accesible y rutinaria como cualquier otro signo vital.
Diversas afecciones, como el engrosamiento de los huesos de la bóveda craneal, la estenosis craneal no tratada (que reduce la capacidad craneal), la circulación venosa anormal (incluyendo trombosis venosa y variaciones anatómicas del drenaje) y la alteración de la circulación glinfática (edema de desplazamiento), pueden contribuir a las primeras etapas del ICS tras una lesión cerebral aguda. Estos factores suelen pasarse por alto en las evaluaciones clínicas rutinarias o en las imágenes estándar durante las evaluaciones iniciales del paciente.
La integración temprana de sistemas de neuromonitorización no invasivos, desde el servicio de urgencias, y la integración temprana de sistemas invasivos en la UCI, proporciona información valiosa sobre cómo estas afecciones afectan la perfusión cerebral, lo que lleva a una adopción global más amplia. Este nuevo enfoque mejora el triaje de pacientes y permite la identificación temprana de señales de alerta, fomentando una estrategia de tratamiento más personalizada y precisa bajo el marco MK 4.0. La reciente publicación del consenso B-ICONIC sobre la monitorización no invasiva de la PIC, junto con esfuerzos previos para evaluar el papel de los sistemas invasivos (los protocolos SIBICC), representa un importante paso inicial hacia el establecimiento de una base conceptual para la validación del ICS en futuras investigaciones clínicas.
La relevancia del sistema glinfático en MK 4.0
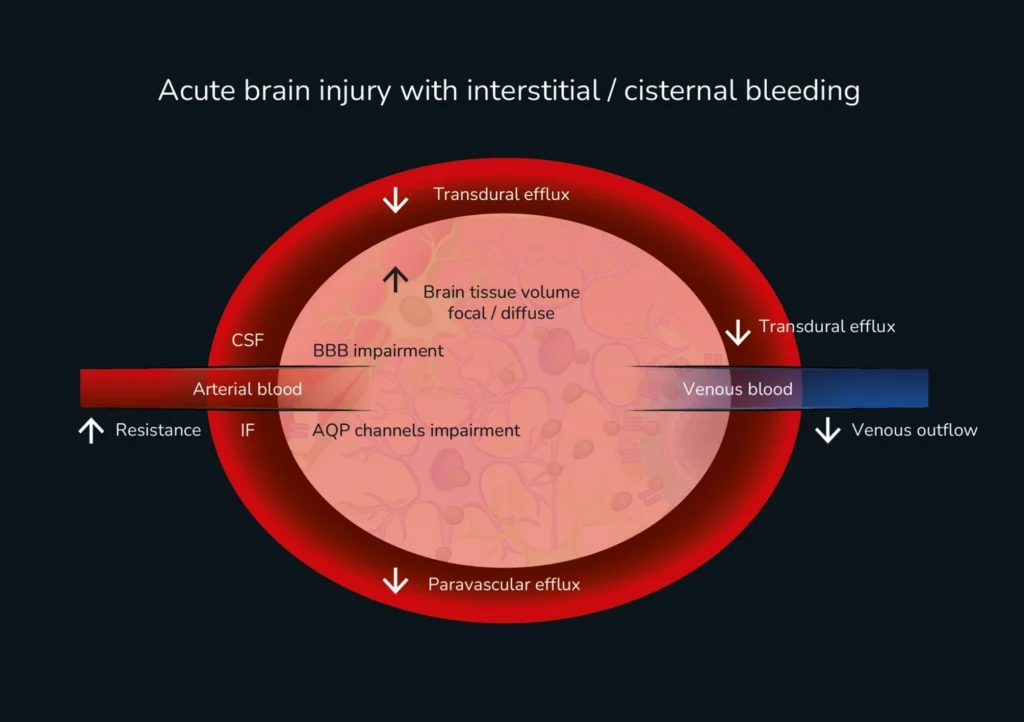
Al analizar la doctrina MK en relación con los componentes de la cavidad craneal y su influencia en la PIC, el espacio intersticial (EI) se ha considerado tradicionalmente un factor secundario. Esto probablemente se deba a su pequeña fracción de volumen (aproximadamente el 3,5%) dentro del compartimento craneal. Sin embargo, avances fisiopatológicos recientes han redefinido esta perspectiva, destacando el EI y sus componentes como contribuyentes clave a la dinámica intracraneal. A diferencia de la mayoría de los tejidos, el parénquima cerebral carece de un sistema linfático convencional, excepto las meninges, que se conectan a vasos y ganglios linfáticos extracraneales, principalmente en el cuello. En consecuencia, la eliminación de desechos cerebrales se ha atribuido tradicionalmente a la degradación o eliminación intracelular a través del torrente sanguíneo a través de la barrera hematoencefálica, basándose en mecanismos de difusión lenta o transporte activo.
La función del EG requiere un gasto energético significativo y está impulsada principalmente por la pulsatilidad arterial (flujo paraarterial), los gradientes de presión del LCR, los ciclos respiratorios y el tono vasomotor. El intercambio de fluidos entre el SI y el LCR ocurre en la porción terminal del espacio de Virchow-Robin por difusión, donde la ausencia de una matriz fibrosa ofrece una resistencia mínima. El transporte de fluidos y solutos a través del SI cerebral hasta el espacio venoso perivascular es impulsado por el flujo convectivo, donde los astrocitos AQP4 desempeñan un papel crucial al facilitar el movimiento del agua a través de las membranas celulares. Una vez en el espacio venoso, el fluido intersticial acumulado sale del cerebro y drena hacia el sistema linfático cervical. Este mecanismo promueve la eliminación de desechos metabólicos de la actividad celular y modula la excitabilidad neuronal al afectar indirectamente el equilibrio iónico y la homeostasis de los neurotransmisores.
La disfunción del GS se ha relacionado con múltiples mecanismos de daño celular y tisular (Fig. 3). Como consecuencia de la respuesta a la lesión, la neuroinflamación y las cascadas inmunitarias (TNF-α, interleucinas-1β, 6,8,10, IFN-γ y metaloproteinasas de matriz MMP2-MMP9) en el espacio intersticial (EI) contribuyen a la formación y progresión del edema cerebral. En cuanto al espacio subaracnoideo (ES), el concepto más significativo considerado en Monro-Kellie 4.0 es la hipótesis del edema por desplazamiento. Según esta teoría, los pacientes con hemorragia subaracnoidea traumática o espontánea pueden desarrollar edema cerebral secundario debido a la obstrucción del ES. Al extraer los eritrocitos lesionados del espacio subaracnoideo, la cisternostomía puede ayudar a restaurar la función glinfática, lo que conduce a una mejor regulación de la PIC, una mayor depuración de metabolitos neurotóxicos y una reducción del edema cerebral. La evidencia emergente sugiere que un drenaje cisternal eficaz mejora el flujo perivascular, favorece la homeostasis del líquido cefalorraquídeo y puede facilitar la recuperación neurológica.
Aunque aún faltan ensayos prospectivos a gran escala, varias estrategias terapéuticas adicionales dirigidas a mejorar la función del ES muestran un potencial clínico prometedor. Algunos enfoques incluyen optimizar los niveles de sedación y analgesia, modular los patrones de sueño, reducir la actividad de las catecolaminas, apuntar a AQP4 y los receptores asociados (por ejemplo, SUR1) y crear gradientes osmóticos para estimular el flujo convectivo.
Evaluación del cambio de paradigma MK 4.0 por parte del servicio de urgencias
En los enfoques tradicionales, la disfunción del componente principal de la PIC (PIC) se limitaba a la UCI mediante sistemas de medición invasivos, habitualmente disponibles en entornos con altos recursos. Con este nuevo enfoque, el proceso puede iniciarse antes, ya que la identificación del deterioro de la compliancia intracraneal mediante al menos dos métodos no invasivos diferentes —como la pupilometría, el análisis no invasivo de la forma de onda de la PIC, la ecografía del nervio óptico o el Doppler transcraneal— puede proporcionar al equipo clínico información valiosa sobre los procesos fisiopatológicos que ocurren dentro del cráneo. En regiones sin acceso a tomografías computarizadas (TC), esta evaluación ayuda a determinar la urgencia del traslado del paciente. En centros con TC, la combinación de imágenes de la lesión primaria con la evaluación de la compliancia intracraneal mejora la toma de decisiones, permitiendo intervenciones quirúrgicas más precisas y oportunas.
La Figura 4 presenta un caso de TCE con una fractura de cráneo frontal deprimida con una pequeña contusión frontobasal, neumoencéfalo leve y una ligera desviación de la línea media inferior a 5 mm. Según los protocolos actuales, la lesión primaria no requiere cirugía inmediata. Sin embargo, al menos tres sistemas de monitorización no invasiva detectaron anomalías de la compliancia intracraneal. A pesar de estos hallazgos, el Índice Pupilar Neurológico (IPN) permanece normal en ambos lados, lo que indica que el paciente aún no presenta hernia cerebral. Dados los hallazgos anormales de compliancia, es necesaria una monitorización continua urgente de la compliancia cerebral y la oxigenación mediante sistemas invasivos o no invasivos. Además, el estado de autorregulación y la actividad eléctrica deben reevaluarse con frecuencia en la UCI.
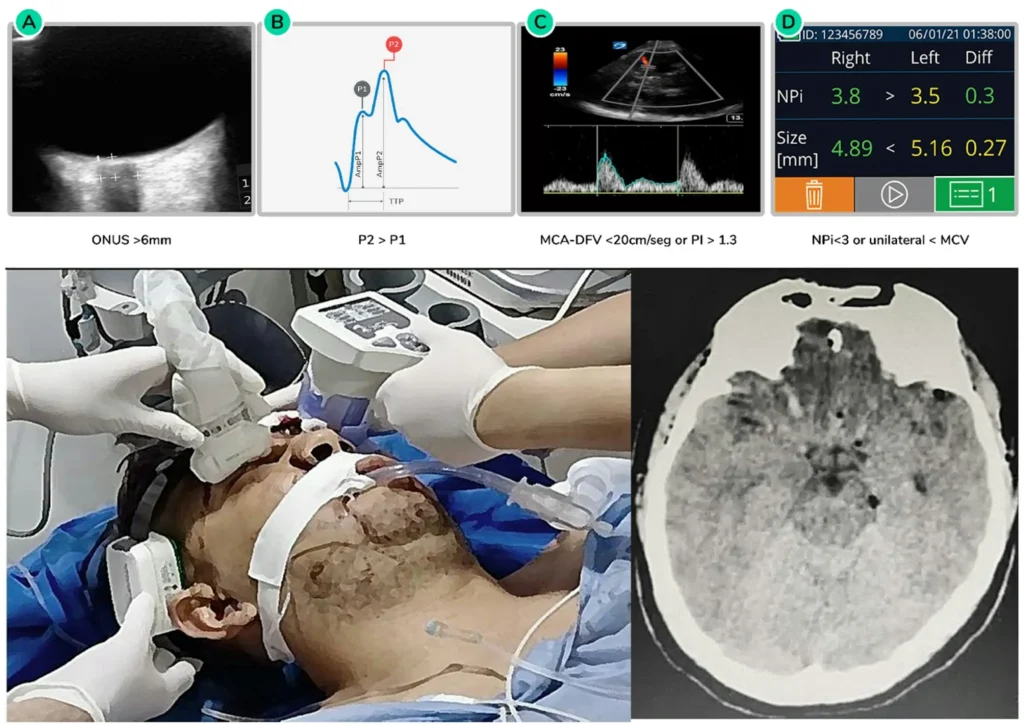
Si no se dispone de monitorización invasiva en una UCI, se pueden realizar evaluaciones no invasivas al menos tres o cuatro veces al día para rastrear las tendencias. Si se produce un deterioro a pesar del tratamiento médico, se debe considerar una intervención quirúrgica temprana para mejorar la adherencia en el lado más afectado. Si se dispone de monitorización invasiva, la medición continua también permitirá identificar alteraciones de la adherencia o la oxigenación. Como se mencionó anteriormente, los métodos de drenaje de LCR, como el drenaje ventricular externo (DVE), el drenaje lumbar externo (DLE) o la cisternostomía, desempeñan un papel crucial más allá de la simple reducción del volumen intracraneal. En última instancia, la descompresión craneal debe considerarse como último recurso si el paciente no mejora con intervenciones previas.
Limitaciones del enfoque MK 4.0
Las lesiones cerebrales agudas, en particular el TCE grave, son afecciones muy heterogéneas, lo que dificulta el diseño y la ejecución de ensayos clínicos intervencionistas. Queda por demostrar si el reconocimiento temprano de lesiones cerebrales secundarias mediante este enfoque puede mejorar la evolución de los pacientes. La asociación del modelo de neuromonitorización invasiva y no invasiva propuesto por el consenso B-ICONIC aún no se ha sometido a validación prospectiva. Además, si bien los conocimientos fisiopatológicos presentados en este manuscrito resaltan la importancia de la función glifática y la AC, aún se están desarrollando estrategias definitivas para restaurar la función glifática o determinar los rangos óptimos de AC.
Conclusión
La doctrina Monro-Kellie debe evolucionar para reflejar los últimos avances en fisiología y tecnología cerebral. La actualización MK 4.0 integra los descubrimientos recientes sobre la autorregulación cerebrovascular y el sistema glinfático, reconociéndolos como factores clave para la dinámica y la distensibilidad intracraneales. Al redefinir estos principios, la doctrina proporciona un marco más preciso para comprender y gestionar las neuroemergencias, allanando el camino para estrategias de tratamiento más eficaces y personalizadas.


